晚期非小細胞肺癌是肺癌中最常見的類型,指腫瘤已發生遠處擴散或轉移(如轉移到對側肺、胸膜、骨骼、腦部等),無法通過手術根治的階段。此時,治療目標主要是控制病情進展、延長患者生存期和改善生活質量。盡管分子靶向治療和免疫檢查點抑制劑在晚期非小細胞肺癌的治療中取得進展,但患者的5年生存率仍僅為20%左右。因此,臨床上亟需一種新型治療策略來進一步提高患者的存活率和生存質量。
溶瘤病毒是一類能夠選擇性感染并摧毀腫瘤細胞,同時不損傷正常細胞的癌癥療法。該療法潛力巨大,但溶瘤病毒作為單藥治療時仍面臨諸多挑戰。因此,將溶瘤病毒與其他治療方式聯合應用已成為攻克腫瘤免疫治療難題的一個重要研究方向以及新型治療策略。
在這一研究背景下,2025年8月日本香川大學醫學部在期刊《Cancers》上發表了一篇題為《Antitumor Effects of Combination Therapy with Oncolytic Vaccinia Virus and Tepotinib on Lung Cancer Cells》的文章。

研究者系統評估了一種經過工程改造,在癌細胞中選擇性復制的溶瘤痘苗病毒與已知能增強免疫反應的MET抑制劑tepotinib的聯合效果:能夠有效抑制腫瘤生長并增加免疫細胞浸潤。
MDRVV和Tepotinib對肺癌細胞系的細胞毒性作用
研究者評估了MDRVV和tepotinib對肺癌細胞系A549、EBC-1和3LL的細胞毒性作用。細胞在培養3天后,用不同濃度的兩種藥物處理,計數細胞數量。盡管敏感性有差異,所有細胞在MDRVV或tepotinib處理下還是均發生細胞死亡。兩種藥物的組合產生了疊加細胞毒性效應(圖1)。同時在所有三種細胞系中,通過Western blotting檢測到了ERK1/2的磷酸化。
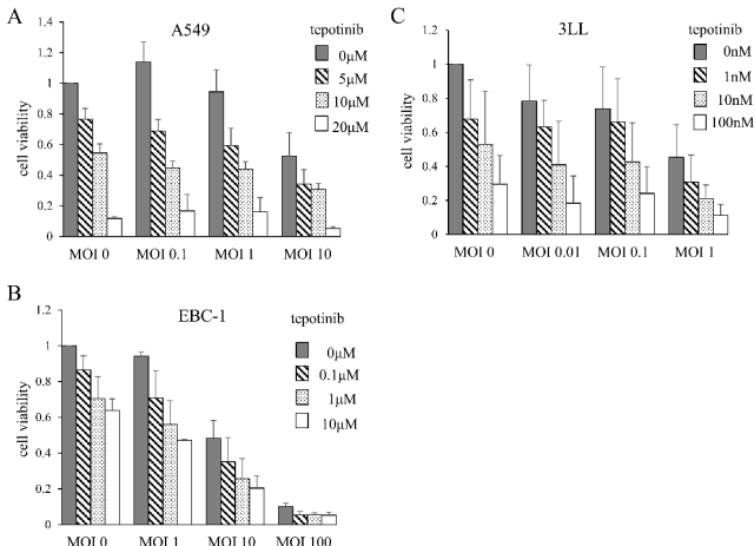
圖1.MDRVV(MAPK依賴性重組痘苗病毒)與tepotinib(MET抑制劑)對肺癌細胞系的細胞毒性作用
培養上清液中的ATP濃度和HMGB-1表達
為了研究MDRVV是否誘導免疫原性細胞死亡,研究者測量了A549細胞培養上清液中的ATP濃度并評估了HMGB-1表達。MDRVV給藥后,培養上清液中的ATP濃度在72至96小時達到峰值(圖2A)。tepotinib或順鉑處理后未觀察到ATP濃度增加(圖2B)。收集MDRVV處理A549細胞3天后的上清液,使用Western blotting確認HMGB-1釋放(圖2C)。ATP和HMGB-1水平升高表明MDRVV誘導免疫原性細胞死亡。
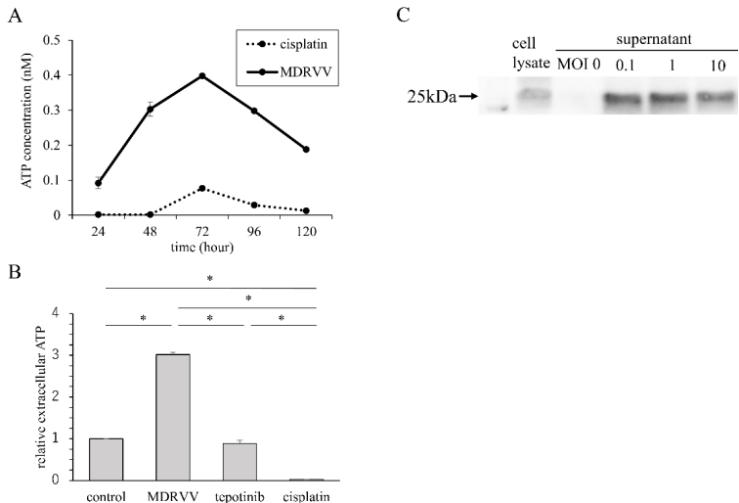
圖2.A549細胞中免疫原性細胞死亡相關分子的增加
聯合治療抑制小鼠腫瘤進展
為了研究MDRVV是否發揮免疫介導的抗腫瘤效應,研究者使用具有完整免疫系統的C57BL/6小鼠,將200萬個3LL細胞皮下接種到小鼠背部的兩個部位。一周后觀察到腫瘤形成。MDRVV僅在一個腫瘤中于第1天和第6天瘤內注射。Tepotinib每日腹腔注射。結果顯示,與對照組相比,聯合治療組在MDRVV注射瘤與非注射瘤中均表現出顯著的腫瘤生長抑制(圖3A,B)。基于腫瘤生長導致安樂死終點繪制的Kaplan–Meier生存曲線表明,MDRVV和tepotinib單藥治療組與對照組相比均具有顯著生存優勢(均p<0.05,圖3C);MDRVV和tepotinib組之間無顯著差異(p=0.88);聯合治療組比MDRVV或tepotinib單藥治療組(均p<0.05)和對照組(p<0.001,圖3C)生存期顯著延長。
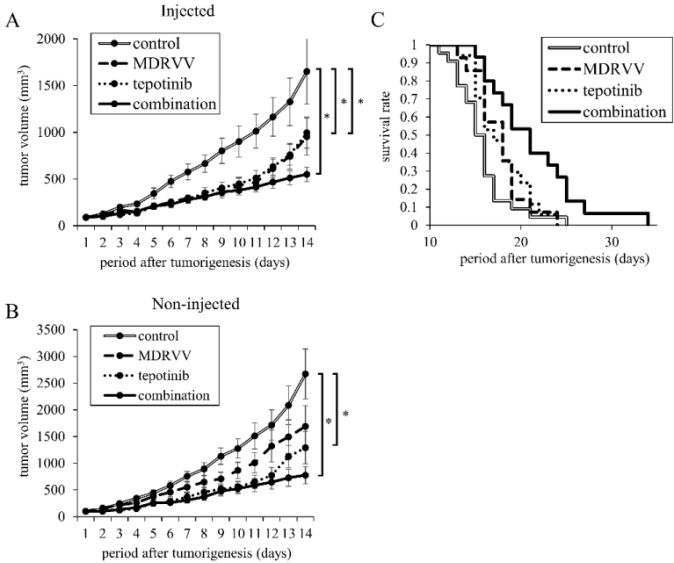
圖3.MDRVV與tepotinib對小鼠腫瘤進展及生存情況的影響
治療后腫瘤的病理學分析
小鼠腫瘤組織樣本進行蘇木精-伊紅染色后觀察發現,各組間未見明顯的淋巴細胞浸潤差異。為了研究MDRVV和tepotinib的免疫調節效應,研究者進行了CD4和CD8的免疫組織化學染色(圖4)。在注射和未注射的腫瘤中,聯合治療組顯示比單藥組更高的CD4+和CD8+細胞浸潤。具體而言,聯合治療組中CD8+細胞浸潤顯著更高,表明更強的免疫反應。
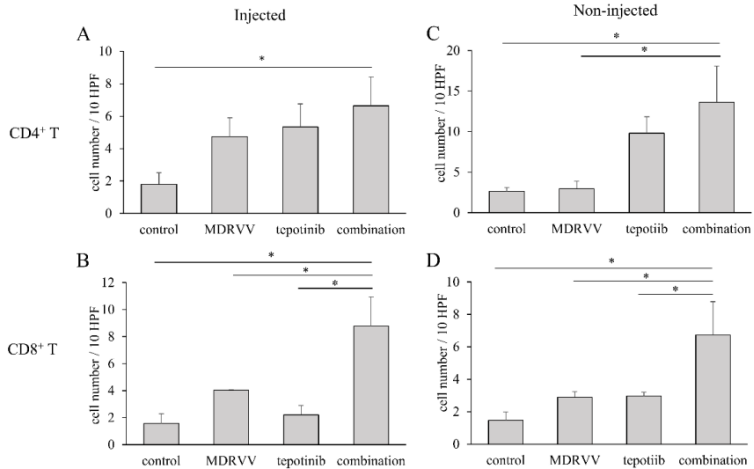
圖4.腫瘤浸潤淋巴細胞
結論:本研究證實MDRVV與tepotinib聯合治療通過雙重機制發揮抗腫瘤作用:MDRVV誘導免疫原性細胞死亡(ATP/HMGB-1釋放),tepotinib逆轉免疫抑制微環境,協同促進CD4+/CD8+T細胞浸潤,實現局部與遠處腫瘤的同步抑制。該組合成功將"冷腫瘤"轉化為"熱腫瘤",通過激活癌癥-免疫循環增強系統性抗腫瘤免疫。同時該聯合治療方案需進一步探索靜脈給藥劑量、PD-L1動態變化及詳細免疫譜分析,為臨床轉化提供更充分依據。
這項研究揭示了聯合療法在腫瘤治療中的巨大潛力,而要將這種潛力轉化為可臨床應用的現實,離不開專業的溶瘤病毒候選株構建與藥效評價平臺——而這正是迪福潤絲生物的核心業務。
迪福潤絲生物溶瘤病毒候選株構建服務
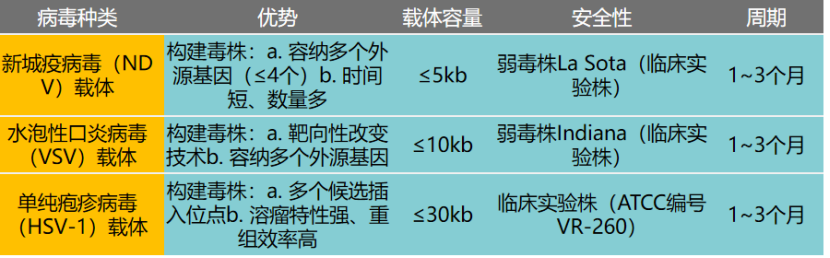
迪福潤絲生物在溶瘤病毒藥物的臨床前研究方面具備系統化平臺能力。公司通過對病毒株基因組進行改造,以提升溶瘤病毒的抗腫瘤活性。目前,公司可改造的溶瘤病毒載體涵蓋新城疫病毒(NDV)、水皰性口炎病毒(VSV)、單純皰疹病毒(HSV-1)等,已建立起多種類型的小鼠腫瘤模型,可為不同腫瘤提供系統性的溶瘤病毒有效性評價服務。
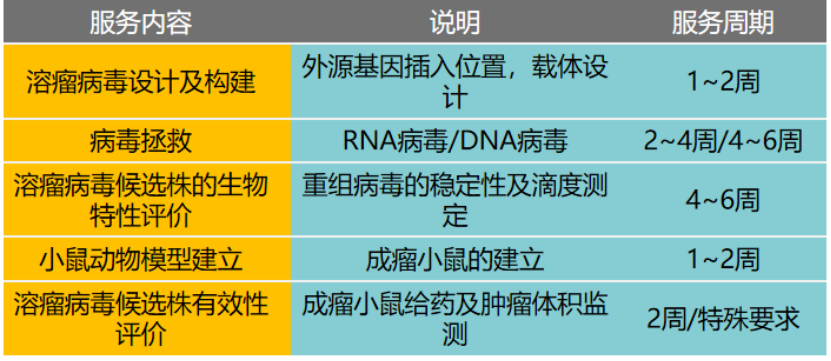
服務內容:
服務案例:
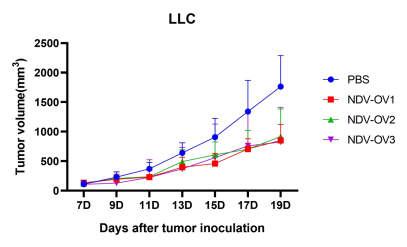
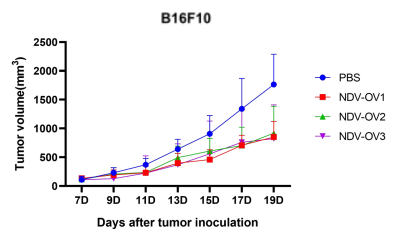
圖5. 以NDV為載體的改造溶瘤病毒候選株(NDV-OV1,NDV-OV2,NDV-OV3)給藥后,成瘤小鼠腫瘤體積變化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
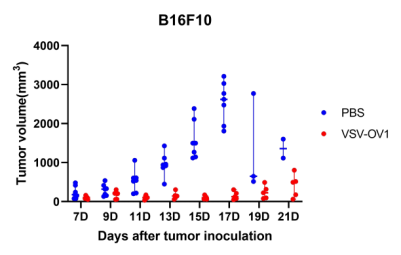
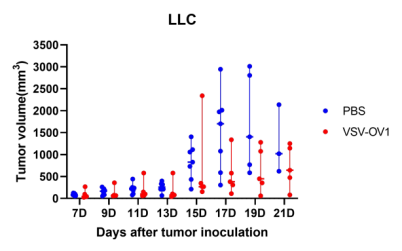
圖6. 以VSV為載體的改造溶瘤病毒候選株(VSV-OV1)給藥后,成瘤小鼠腫瘤體積變化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
DIFF溶瘤病毒平臺核心優勢:
基于迪福潤絲反向遺傳操作技術平臺(Viraltech Architect),可對絕大部分病毒進行基因工程改造。平臺通過模塊化的DCVL(Design-Construct-Verify-Learn)的方式,進行實驗數據積累與更新迭代。
DIFF NDV載體優勢:
DIFF VSV載體優勢:
迪福潤絲生物依托全球領先的重組病毒載體技術平臺,為溶瘤病毒療法提供全流程CRO專業支持:從溶瘤病毒候選株構建(如新城疫病毒NDV、水皰性口炎病毒VSV載體等)、到動物模型藥效評價以及活體成像分析。公司擁有專注于P2病毒類動物模型評價的企業實驗室,加速創新療法從實驗室向臨床轉化,助力企業IND申報成功!
參考文獻:
Inoue T, Kanaji N, Nakamura T, et al. Antitumor Effects of Combination Therapy with Oncolytic Vaccinia Virus and Tepotinib on Lung Cancer Cells. Cancers (Basel). 2025 Aug 18;17(16):2681.
