近年來,基于溶瘤微生物的抗腫瘤策略因其天然腫瘤趨向性與免疫調(diào)節(jié)優(yōu)勢,已成為腫瘤免疫治療領(lǐng)域的研究熱點(diǎn)。
腫瘤特有的低氧狀態(tài)、豐富營養(yǎng)供給及免疫抑制性微環(huán)境,疊加腫瘤細(xì)胞膜表面特異性受體的高豐度表達(dá),共同為溶瘤細(xì)菌與溶瘤病毒在病灶處的定植、入侵及復(fù)制提供了適宜環(huán)境。
不過,如何安全且高效地將溶瘤病毒遞送至靶點(diǎn),仍是當(dāng)前該領(lǐng)域亟待突破的關(guān)鍵技術(shù)難題。
遞送系統(tǒng)的最新突破:
2023年5月,《Nat. Commun》刊登了一項(xiàng)研究,題為《Engineered bacterial outer membrane vesicles encapsulating oncolytic adenoviruses enhance the efficacy of cancer virotherapy by augmenting tumor cell autophagy》的文章。該研究報(bào)道了一種基于工程化細(xì)菌外膜囊泡(OMVs)的OVs靜脈遞送系統(tǒng),能夠提高OVs免疫治療效率。
為解決溶瘤病毒(OVs)在體內(nèi)遞送的關(guān)鍵瓶頸,研究團(tuán)隊(duì)設(shè)計(jì)了一套創(chuàng)新策略:首先借助成熟的脂質(zhì)體包埋工藝,將OVs與脂質(zhì)體進(jìn)行表面結(jié)合,構(gòu)建成lipo-OVs復(fù)合結(jié)構(gòu)。這一處理可有效阻隔體循環(huán)中內(nèi)源性中和抗體對OVs的活性干擾,維持其生物學(xué)功能。在此基礎(chǔ)上,為進(jìn)一步提升靶向遞送效率,研究者引入了安全性優(yōu)異、腫瘤趨向性突出的非致病性基因工程菌株——大腸桿菌BL21(E. coli BL21),通過生物偶聯(lián)技術(shù)將其與lipo-OVs整合,形成大腸桿菌-脂質(zhì)體-溶瘤病毒復(fù)合遞送系統(tǒng)(E. coli-lipo-OVs)。該復(fù)合系統(tǒng)成功克服了OVs單獨(dú)靜脈輸注時(shí)的靶向性不足與活性易受抑制等局限,最終達(dá)成抗腫瘤效果增強(qiáng)與毒副作用降低的協(xié)同治療目標(biāo)。
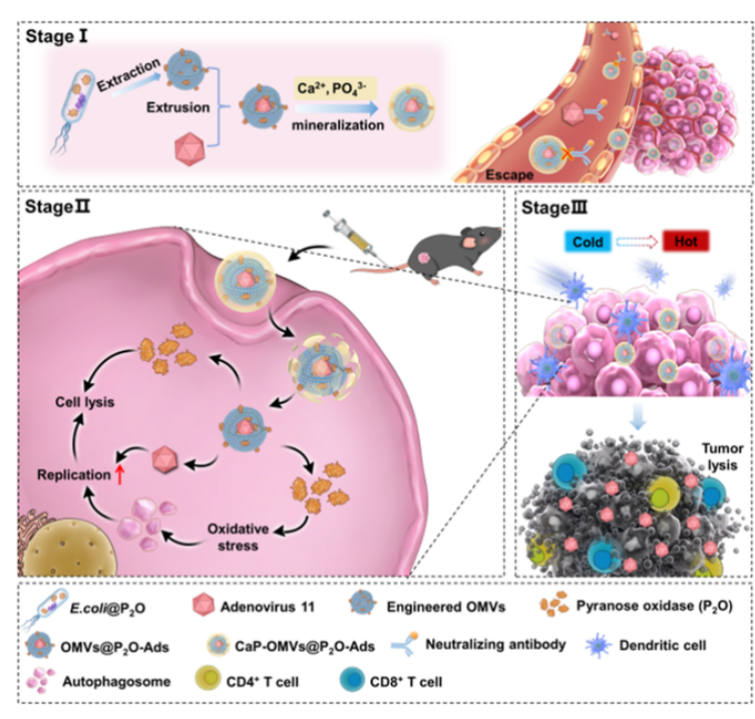
圖1.工程化復(fù)合微生物體的構(gòu)建及免疫增效研究
2025年7月,哥倫比亞大學(xué)Tal Danino團(tuán)隊(duì)在《自然生物醫(yī)學(xué)工程》(Nature Biomedical Engineering)發(fā)表了一項(xiàng)突破性研究,題為“Engineered bacteria launch and control an oncolytic virus”。該團(tuán)隊(duì)通過減毒沙門氏菌構(gòu)建智能遞送系統(tǒng),包裹溶瘤塞內(nèi)卡病毒RNA并靶向遞送至腫瘤微環(huán)境,同時(shí)引入合成生物學(xué)調(diào)控回路,成功達(dá)成免疫躲避、定向擴(kuò)散與安全管控的多重目標(biāo)。

與常規(guī)直接輸注病毒的治療方案不同,這一技術(shù)的核心設(shè)計(jì)思路在于利用細(xì)菌構(gòu)建動(dòng)態(tài)防護(hù)屏障及關(guān)鍵蛋白酶,促使病毒在腫瘤區(qū)域內(nèi)完成成熟與復(fù)制擴(kuò)增。這種策略不僅避免了病毒被抗體中和的問題,同時(shí)通過限制病毒作用空間,實(shí)現(xiàn)了治療效果的精準(zhǔn)化與安全性提升。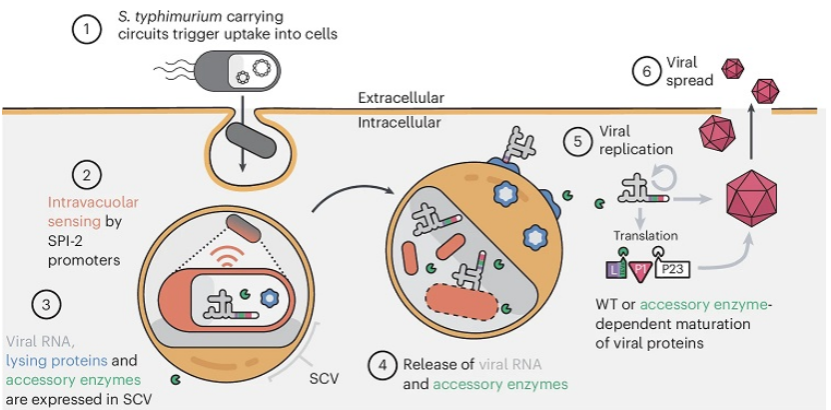
圖2. 工程化沙門氏菌在宿主細(xì)胞內(nèi)裂解釋放病毒 RNA 及正交蛋白酶,啟動(dòng) CAPPSID 平臺功能
CAPPSID的技術(shù)架構(gòu)依托三項(xiàng)關(guān)鍵的工程化改造實(shí)現(xiàn)突破:
首先,研究團(tuán)隊(duì)對沙門氏菌的基因組進(jìn)行了編輯,整合了一個(gè)能感知低氧環(huán)境的調(diào)控模塊(即SPI-2啟動(dòng)子)。當(dāng)細(xì)菌進(jìn)入腫瘤微環(huán)境時(shí),這一模塊會(huì)特異性驅(qū)動(dòng)裂解蛋白的表達(dá),導(dǎo)致細(xì)菌細(xì)胞裂解并釋放內(nèi)部攜帶的病毒RNA。這種設(shè)計(jì)確保了病毒復(fù)制進(jìn)程僅在特定條件下啟動(dòng),從而避免了其過早暴露于免疫系統(tǒng)。
其次,塞內(nèi)卡病毒的結(jié)構(gòu)蛋白切割位點(diǎn)被重新設(shè)計(jì),使其成熟組裝過程必須依賴TEV蛋白酶對特定序列的識別。由于TEV蛋白酶是工程化細(xì)菌的特有表達(dá)產(chǎn)物,病毒在缺乏細(xì)菌的環(huán)境中無法完成組裝,這種“細(xì)菌依賴型”機(jī)制形成了嚴(yán)格的交叉調(diào)控,有效限制了病毒的擴(kuò)增范圍。
最后,病毒RNA能夠借助宿主細(xì)胞的復(fù)制系統(tǒng)實(shí)現(xiàn)自我增殖。僅需少量細(xì)菌即可觸發(fā)細(xì)胞層面的感染級聯(lián)反應(yīng),通過這種“以少啟多”的方式,局部的治療效應(yīng)得到了顯著放大。
迪福潤絲生物溶瘤病毒候選株構(gòu)建服務(wù)
迪福潤絲生物在溶瘤病毒藥物的臨床前研究方面具備系統(tǒng)化平臺能力。公司通過對病毒株基因組進(jìn)行改造,以提升溶瘤病毒的抗腫瘤活性。目前,公司可改造的溶瘤病毒載體涵蓋新城疫病毒(NDV)、水皰性口炎病毒(VSV)、單純皰疹病毒(HSV-1)等,已建立起多種類型的小鼠腫瘤模型,可為不同腫瘤提供系統(tǒng)性的溶瘤病毒有效性評價(jià)服務(wù)。
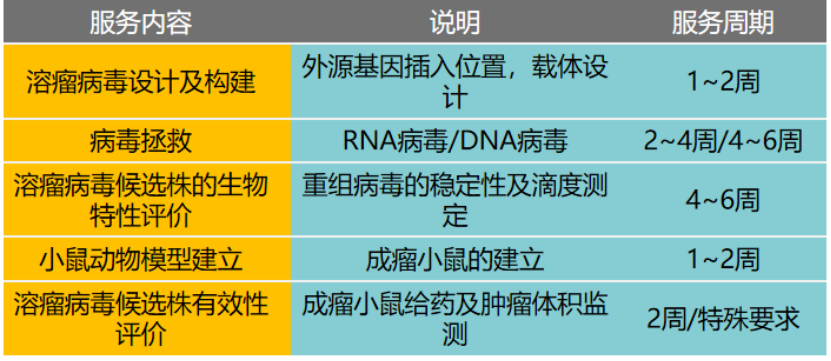
服務(wù)內(nèi)容: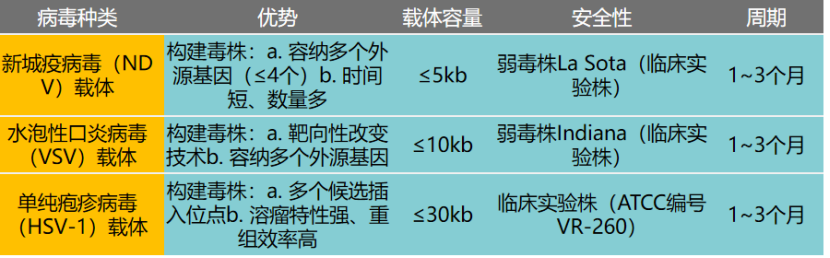
服務(wù)案例:
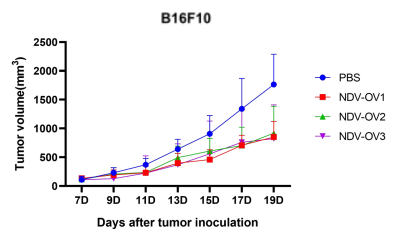
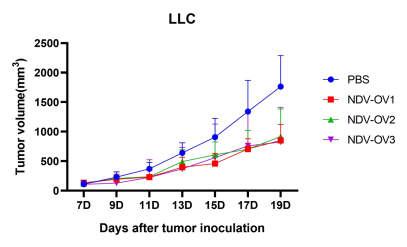

圖3. 以NDV為載體的改造溶瘤病毒候選株(NDV-OV1,NDV-OV2,NDV-OV3)給藥后,成瘤小鼠腫瘤體積變化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。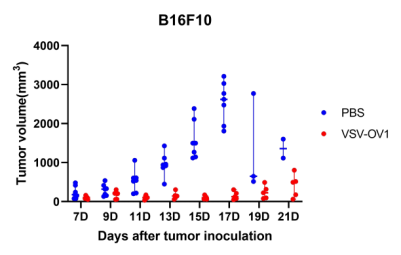
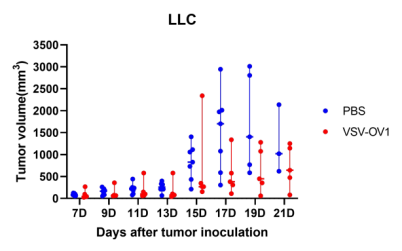
圖4. 以VSV為載體的改造溶瘤病毒候選株(VSV-OV1)給藥后,成瘤小鼠腫瘤體積變化。A:LLC成瘤小鼠;B:B16F10成瘤小鼠。
DIFF溶瘤病毒平臺核心優(yōu)勢:
基于迪福潤絲反向遺傳操作技術(shù)平臺(Viraltech Architect),可對絕大部分病毒進(jìn)行基因工程改造。平臺通過模塊化的DCVL(Design-Construct-Verify-Learn)的方式,進(jìn)行實(shí)驗(yàn)數(shù)據(jù)積累與更新迭代。
具備溶瘤病毒載體類創(chuàng)新藥“閉環(huán)式”持續(xù)開發(fā)能力
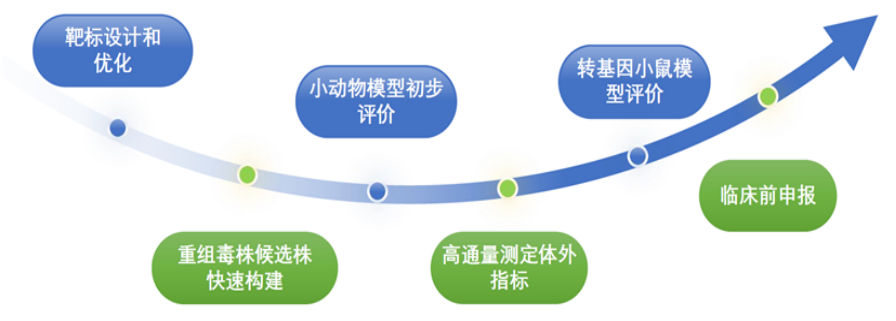

迪福潤絲生物依托全球領(lǐng)先的重組病毒載體技術(shù)平臺,為溶瘤病毒療法提供全流程CRO專業(yè)支持:從溶瘤病毒候選株構(gòu)建(如新城疫病毒NDV、水皰性口炎病毒VSV載體等)、到動(dòng)物模型藥效評價(jià)以及活體成像分析。公司擁有杭州唯一一家專注于P2病毒類動(dòng)物模型評價(jià)的企業(yè)實(shí)驗(yàn)室,加速創(chuàng)新療法從實(shí)驗(yàn)室向臨床轉(zhuǎn)化,助力企業(yè)IND申報(bào)成功!
參考文獻(xiàn):
Sun M, Yang S, Huang H, et al. Boarding Oncolytic Viruses onto Tumor-Homing Bacterium-Vessels for Augmented Cancer Immunotherapy. Nano Lett. 2022 Jun 22;22(12):5055-5064.
Singer, Z.S., Pabón, J., Huang, H. et al. Engineered bacteria launch and control an oncolytic virus. Nat. Biomed. Eng (2025).
關(guān)注福利:關(guān)注本公眾號并連續(xù)3~5天轉(zhuǎn)發(fā)任意2篇文章至朋友圈或行業(yè)交流群,即可領(lǐng)取迪福潤絲定制周邊禮品(充電寶、雨傘等)。詳情請留言公眾號或撥打客服電話咨詢!
掃描下方二維碼,添加「迪福客服」微信聯(lián)系方式,便于您更快地與我們?nèi)〉寐?lián)系:

更多信息
聯(lián)系電話 Tel:0571-86071385
郵箱 E-mail:op@diff-biotech.com
網(wǎng)址 Web:www.diff-biotech.com
Skype: dfrs-public@outlook.com
