生物醫藥是一個具有巨大社會價值,并持續穩定增長的行業,但同時該領域也充滿了挑戰與風險。在傳統模式下,藥物研發通常會面臨“三個10”的困境:即一款創新藥物研發周期往往超過10年,投資超過10億美元,成功率不到10%。
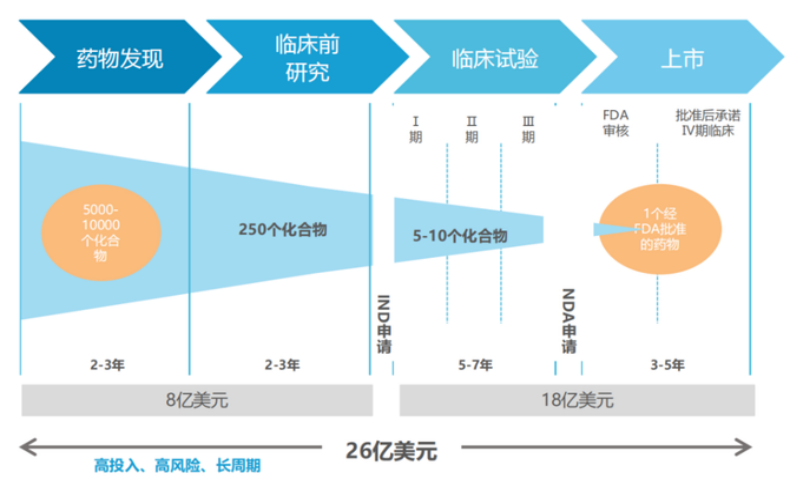
資料來源:塔夫茨(Tufts)藥物開發研究中心數據
在這樣的背景下,AI制藥(AI-driven Drug Discovery)正在成為突破瓶頸的新引擎。AI制藥,是指將機器學習、大數據等人工智能技術應用于制藥全流程,幫助企業提升研發效率與成功率,顯著降低成本。其核心在于通過機器的自主學習,從海量數據中歸納出超越傳統經驗的研發規律,并將其應用到藥物研發的各個階段:早期靶點發現、先導化合物虛擬篩選與優化(包括活性、毒性等關鍵性質預測),到臨床實驗設計、患者招募及老藥新用等多個關鍵環節。借助AI技術,制藥企業能夠以更低成本、更高通量地處理化合物與靶點,有望將藥物發現與臨床前研究時間縮短近40%,并大幅縮短臨床試驗階段的時間。
AI制藥的“雙擎”:CADD與AIDD
在AI制藥的藥物研發過程中,計算機輔助藥物設計(CADD)與人工智能藥物發現(AIDD)是兩大重要支柱。CADD主要基于物理計算方法,如分子對接、自由能微擾等,通過優化力場與采樣算法,提升虛擬篩選的精度與效率,其核心在于模擬分子間相互作用,從而提高靶點識別與化合物優化的成功率。而AIDD則側重于利用機器學習與深度學習技術,從大數據中挖掘隱藏規律,實現蛋白質結構預測、分子生成與性質優化,尤其擅長處理復雜的數據關系,加速靶點發現與化合物設計,但其效果高度依賴數據質量與算法可靠性。兩者在實踐中協同互補:CADD提供堅實的物理解釋性,AIDD則拓展了藥物探索的化學空間,它們共同構成了AI制藥的核心工作流程,如下圖所示:
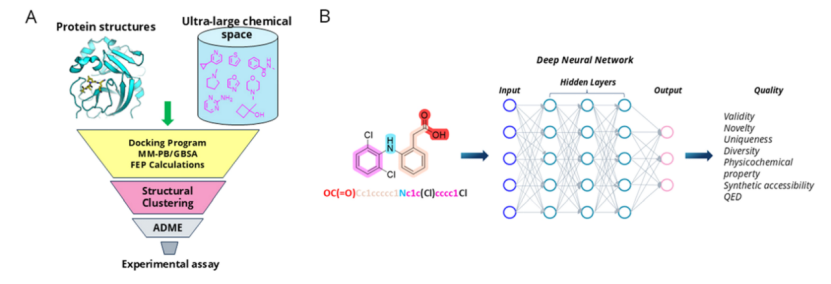
圖1.(A)計算機輔助藥物設計(CADD)的一般工作流程。(B)基于深度學習架構的分子生成。
AI驅動:干濕結合的研發革新
“干濕結合”,也就是“干實驗”(計算實驗)和“濕實驗”(傳統科學實驗)的結合。具體而言,“干實驗”可以對“濕實驗”現有的結論做驗證和補充,還能進行“濕實驗”做不了的或者是需要花很多時間、人力去做的研究。比如,在科學家對新冠病毒奧密克戎株的研究中,若在“濕實驗”實驗室里一個個去分析突變位點結構的變化,可能需要數月時間。而使用計算的手段來模擬這種突變造成的影響,可能只需要一周到兩周的時間。另外,“濕實驗”在前期很多時候都是探索性質的,甚至在研究方向上是非常迷茫的。這時“干實驗”可以在一定程度上引導“濕實驗”的實驗設計,幫助其找到一個更容易成功的方法。
AI驅動的“干濕結合”(即計算實驗與傳統科學實驗相結合)模式已展現出巨大潛力。例如,2021年12月,微軟亞洲研究院與清華大學王新泉教授、張林琦教授團隊合作,在揭示奧密克戎變異株強傳染性機理方面取得突破,相關論文《Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies》已發表于頂級期刊《Cell Research》。

該研究首次綜合運用結構生物學與計算生物學,從動態視角提出了新冠病毒奧密克戎株的感染機制。具體而言,“干實驗”不僅能驗證和補充“濕實驗”的結論;還能高效完成一些傳統實驗難以實現或耗時極長的研究(如快速模擬突變位點的影響),并在“濕實驗”前期為其提供方向性指導。
這種“干濕結合”的強大效力,已在多項抗病毒藥物研發實踐中得到驗證:
實例一:新冠疫情期間,英矽智能利用其AI平臺發現了靶向新冠病毒主蛋白酶(3CL)的口服抑制劑。
實例二:首個獲美國FDA批準的新冠口服藥——輝瑞的奈瑪特韋/利托那韋組合,其發現過程得到了“MareNostrum 4”超級計算機AI算法的輔助。
實例三:由Atomwise公司與多倫多大學研究人員合作開發的廣譜抗病毒藥物加利地韋(Galidesivir),通過AI系統篩選了數百萬種化合物,目前正作為COVID-19潛在治療藥物進行臨床試驗。
在AI制藥通過計算模型加速候選化合物發現的同時,高效可靠的實驗驗證體系成為將算法預測轉化為實際成果的關鍵環節。迪福潤絲生物建立的特色藥效評價平臺,正是連接計算預測與實驗驗證的橋梁,為AI制藥提供了可靠的"濕實驗"支撐。
迪福潤絲藥效評價體系與AI制藥的深度融合
1.蛋白酶抑制劑篩選系統:AI化合物活性的高效驗證平臺?
迪福潤絲自主研發的蛋白酶抑制劑篩選系統,為AI生成的候選化合物提供了快速、可靠的活性驗證方案。該系統不僅能進行初步藥物篩選,還能定量分析候選藥物的劑量-反應關系,計算IC50值。
以新冠病毒3CL主要蛋白酶為例,通過對比活病毒檢測方法與DIFF檢測試劑盒對同一COVID-19蛋白酶抑制劑GC376的檢測結果,發現兩種方法得出的IC50值非常接近。
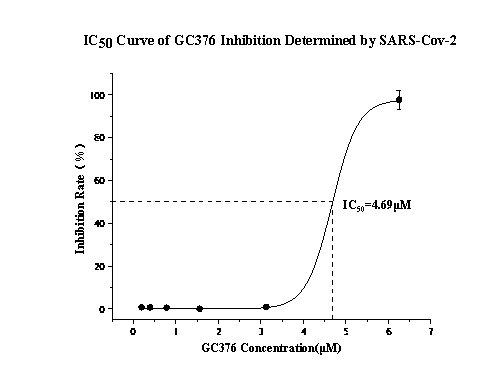
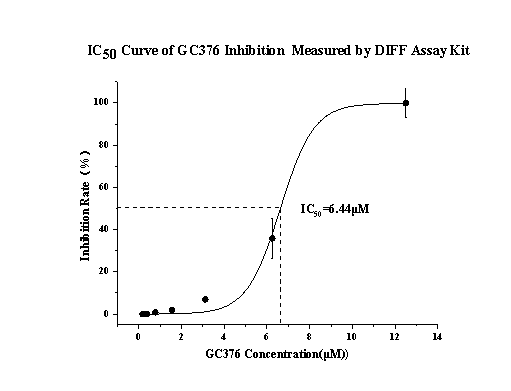
圖3. 蛋白酶抑制劑篩選系統IC50測定結果與真病毒檢測結果對比
這一發現證實了該系統在模擬真實病毒感染環境以評估藥物療效方面的可靠性,為AI虛擬篩選結果提供了堅實的實驗驗證基礎。
2.熒光報告技術:直觀呈現AI藥物設計效果?
迪福潤絲生物的蛋白酶抑制劑檢測系統基于綠色熒光蛋白(GFP)衍生蛋白的熒光報告技術,其核心優勢在于熒光強度與藥物有效濃度呈正相關。這一特性使得AI設計的化合物活性能夠通過肉眼直接觀察熒光變化進行初步判斷。當GC376濃度從1μM增至10μM時,熒光強度顯著增強,直觀顯示了藥物效應的劑量依賴性,為AI算法的優化提供了即時、可視化的反饋。
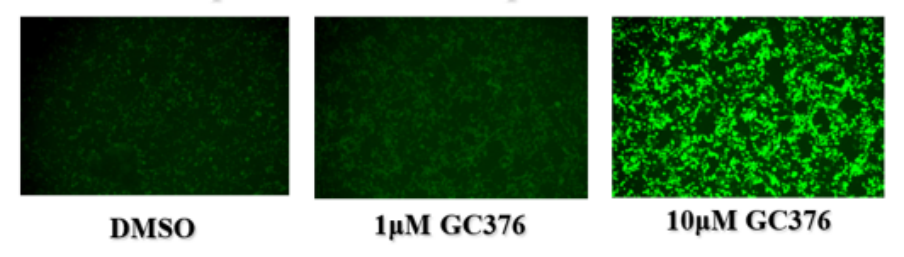
圖4. 蛋白酶抑制劑篩選系統的熒光強度與有效藥物濃度呈正相關
3. 假病毒模型:安全高效的體內藥效評價體系
1)攻毒保護實驗
迪福潤絲采用自主構建的VSV載體新冠假病毒進行疾病動物模型研究。通過對比DIFF新冠假病毒與SARS-CoV-2真病毒感染小鼠模型的表現,發現兩者在體重變化和生存率方面具有高度一致性。這種在BSL-2條件下即可進行的實驗體系,為AI預測的候選藥物提供了安全、高效的體內驗證環境,顯著降低了研發門檻和時間成本。

新冠(SARS-CoV-2)真病毒感染模型(小鼠體重變化)
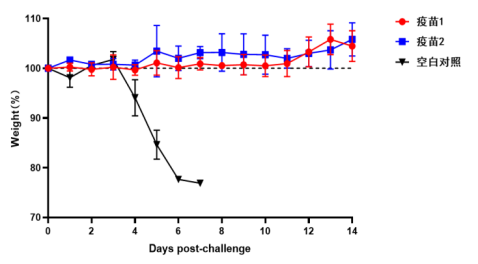
DIFF 新冠假病毒感染模型(小鼠體重變化)
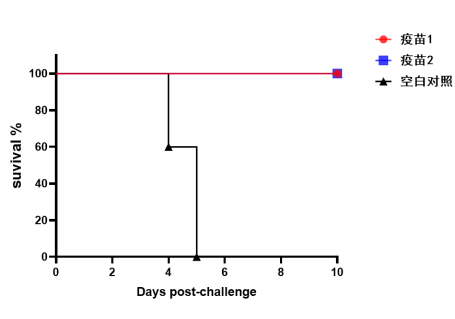
新冠(SARS-CoV-2)真病毒感染模型(小鼠生存率)
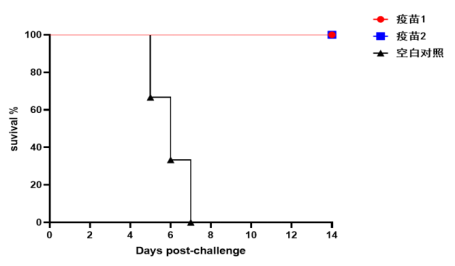
DIFF 新冠假病毒感染模型(小鼠生存率)
組圖5. DIFF新冠假病毒的有效性對比
2)血清中和抗體檢測
基于假病毒的中和抗體檢測平臺,通過eGFP或Luciferase報告基因的表達水平,靈敏地反映樣品中和抗體的水平。該平臺適用于高通量篩選,為AI設計的疫苗候選分子提供了快速、定量的效果評估方案。
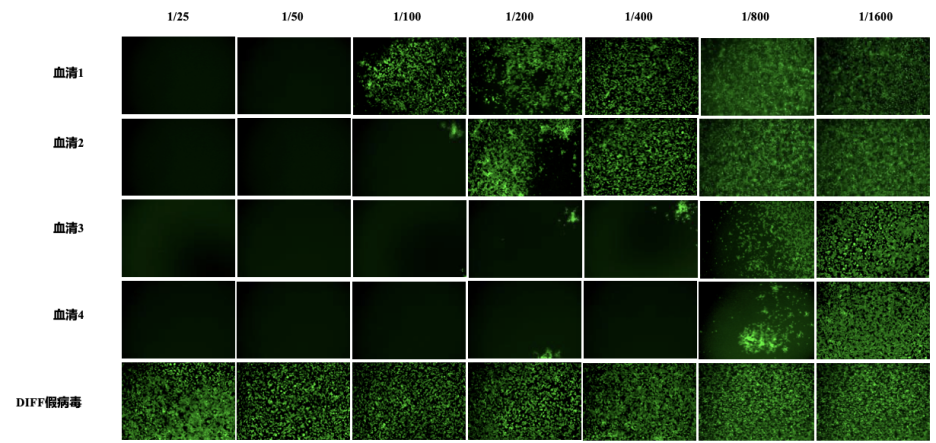
圖6.DIFF新冠假病毒(eGFP報告基因)血清中和抗體檢測案例
迪福潤絲創新藥效評價體系與AI制藥深度協同,構建了獨特的"干濕閉環"研發模式。通過整合高通量活性篩選與高仿生假病毒模型,為AI生成的候選化合物提供全鏈條實驗驗證支持。實驗數據實時反饋至AI系統,形成"計算-驗證-優化"的智能迭代循環,顯著加速臨床前研究進程。這一創新模式成功破解了傳統研發高成本、長周期的困境,為創新療法早日惠及患者提供關鍵助力。
參考文獻:
Xu W. Current Status of Computational Approaches for Small Molecule Drug Discovery. J Med Chem. 2024 Nov 14;67(21):18633-18636.
Anusha K, Jasmitha KSM, Sattibabu K, et al. Integrating of Artificial Intelligence in Drug Discovery and Development: A Comparative Study. Pharmacophore. 2023;14(3):35-40
Cao Y, Wang J, Jian F, et al.. Omicron escapes the majority of existing SARS-CoV-2 neutralizing antibodies. Nature. 2022 Feb;602(7898):657-663.
