
期刊:Cancer Immunology, Immunotherapy
影響因子:5.1
伯豪技術服務+產品:scRNA-seq、伯優®單細胞測序組織保存液
導語
免疫檢查點抑制劑(ICIs)在癌癥治療中取得了顯著的突破,為晚期疾病患者提供了持久的生存益處。作為一種關鍵的治療方法,新輔助治療旨在通過全身治療在手術前控制腫瘤,從而減少術后復發和轉移,同時提高總生存期(OS)和無病生存期(DFS)。新型ICIs的出現,包括nivolumab、atezolizumab、pembrolizumab和avelumab,顯著擴大了治療選擇,為晚期膀胱癌患者帶來了新的希望。然而,盡管取得了這些進展,腫瘤異質性和對ICIs的獲得性耐藥性仍然是限制治療效果的重大挑戰。解決這些挑戰需要對膀胱癌異質性和針對個體患者特征的精準聯合策略有更深入的了解。因此,闡明免疫治療耐藥性的分子機制對于推進更有效的治療方法至關重要。
代謝重編程在腫瘤進展中發揮重要作用,而谷氨酸轉運蛋白SLC1A6可能與腫瘤代謝和免疫治療耐藥性相關。在這項研究中,使用單細胞 RNA 測序分析確定 SLC1A6 是膀胱癌免疫治療耐藥的關鍵驅動因素。對公開可用的肺癌單細胞數據集以及來自膀胱癌和肺癌隊列的轉錄組數據的分析進一步支持了其臨床相關性。在體外和體內進行的功能測定提供了額外的證據,支持其在免疫逃避和治療耐藥性中的作用。我們的研究結果表明,靶向 SLC1A6 可能代表了提高癌癥新輔助免疫治療療效的一種有前途的策略。
關鍵技術
scRNA-seq、伯優®單細胞測序組織保存液
(技術服務及科技產品由伯豪生物提供)
研究結果
1. 膀胱癌患者新輔助免疫治療的單細胞RNA測序分析
為了探究與膀胱癌新輔助免疫治療耐藥性相關的因素,我們對接受了新輔助免疫治療的8位膀胱癌患者進行了單細胞RNA測序分析,其中包括4例免疫治療敏感病例和四例免疫治療耐藥病例(圖1A)。經過嚴格的質量控制措施和標準單細胞分析流程,包括批次效應校正和降維,無監督聚類共識別出20個細胞簇。這些細胞簇根據典型的標志物被歸類為八種主要的細胞類型:上皮細胞(腫瘤細胞)(EPCAM)、T細胞(CD3D, GZMB)、B細胞(CD79A, MS4A1)、漿細胞(JCHAIN)、髓系細胞(LYZ, CD68)、肥大細胞(TPSAB1)、成纖維細胞(FAP, COL1A1)和內皮細胞(VWF)(圖1B)。值得注意的是,免疫治療耐藥患者中的細胞群主要由腫瘤細胞組成,而T細胞亞群在術前新輔助免疫治療耐藥組中的比例有所降低(圖1C, D)。用于注釋細胞亞群的標志性分子如圖1E。
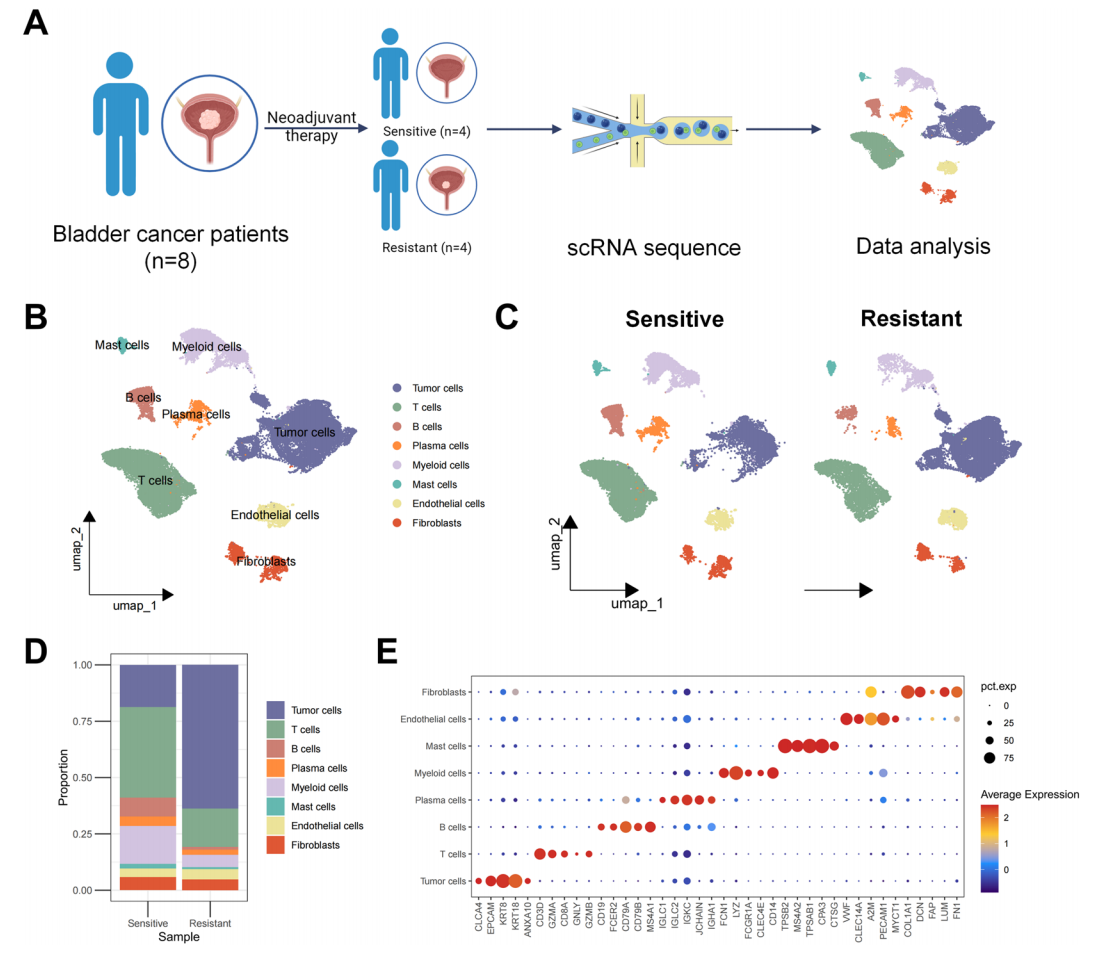
圖 1
2. SLC1A6與膀胱癌免疫治療耐藥性相關
為了進一步鑒定與膀胱癌新輔助免疫治療耐藥性相關的關鍵分子,我們對上皮細胞進行了重新聚類,共識別出七個不同的腫瘤亞簇(圖2A)。比較治療耐藥組和治療敏感組亞簇的組成發現,腫瘤c7亞簇在耐藥組中特異性富集(圖2B)。圖2C展示了定義每個腫瘤亞簇的關鍵標志基因。隨后,我們對敏感組和耐藥組腫瘤細胞進行了差異表達分析。在耐藥組中顯著上調的基因中,SLC1A6被鑒定出來。值得注意的是,SLC1A6特異性地在腫瘤c7亞簇中表達,該亞簇在免疫治療耐藥組中特異性富集(圖2D)。腫瘤c7亞簇中差異表達基因的GSEA顯示,與其他亞簇相比,免疫激活通路下調(圖2E)。綜合這些發現表明,SLC1A6與膀胱癌新輔助免疫治療耐藥性相關。
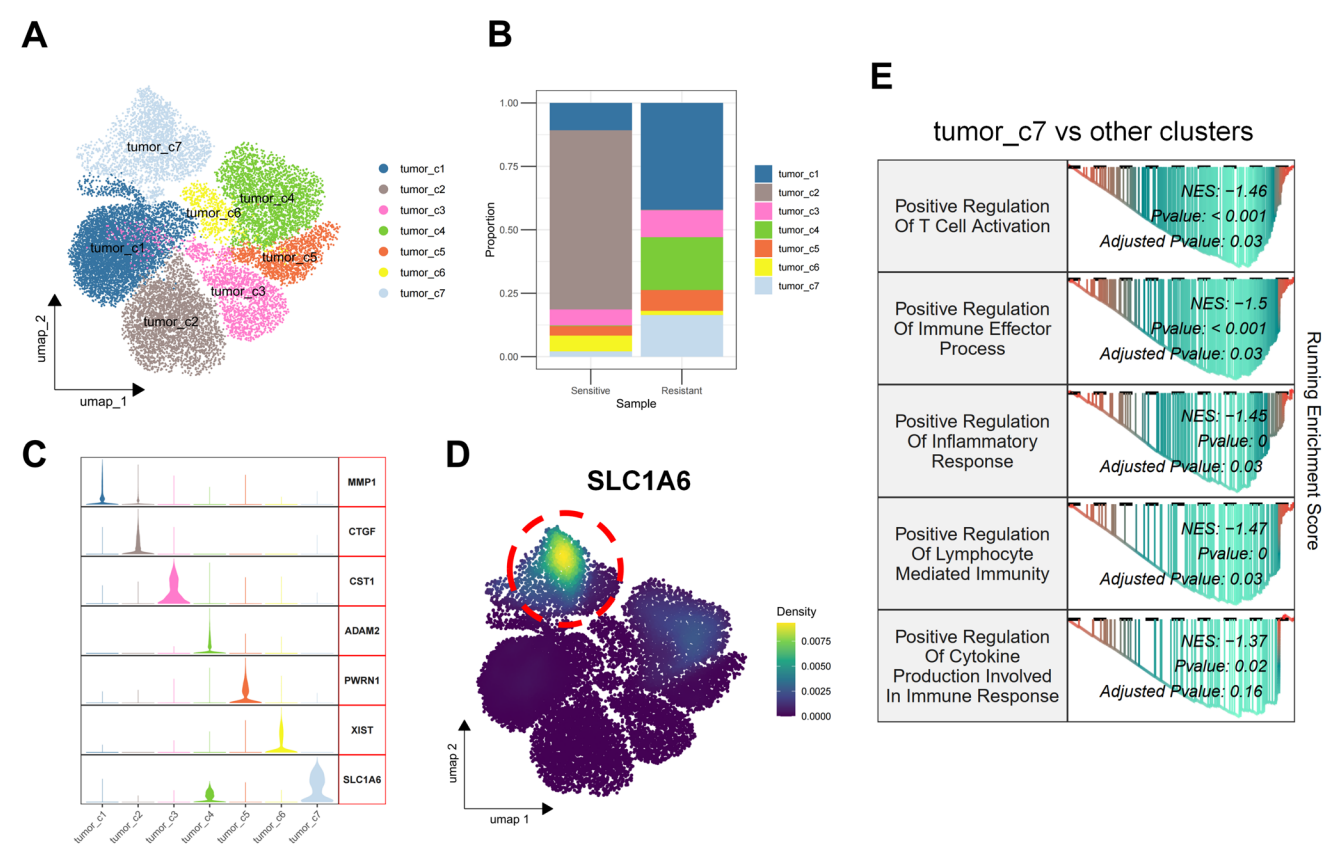
圖 2
3. SLC1A6表達與膀胱癌進展和免疫浸潤的相關性
為了進一步評估SLC1A6在膀胱癌中的臨床意義,我們從TCGA數據庫收集并分析了數據。我們的發現表明,SLC1A6在腫瘤組織中的表達顯著高于正常組織(圖3A)。此外,我們比較了膀胱癌患者不同病理T和N階段SLC1A6的表達水平,并觀察到SLC1A6表達與晚期病理T和N階段呈正相關,更高的表達水平與疾病進展相關(圖3B, C)。接下來,我們根據表達水平將膀胱癌患者分為SLC1A6低表達組和SLC1A6高表達組。生存分析顯示,SLC1A6低表達組的患者預后優于SLC1A6高表達組的患者(圖3D)。GSEA進一步揭示,SLC1A6低表達與免疫激活通路相關(圖3E, F)。然后,我們應用CIBERSORT、ESTIMATE和ssGSEA算法評估兩組的免疫浸潤(圖3G, H)。結果顯示,SLC1A6低表達組表現出更高的免疫浸潤評分和ESTIMATE評分,表明免疫浸潤增強和腫瘤純度降低。此外,SLC1A6低表達組表現出免疫細胞浸潤增加,尤其是具有抗腫瘤活性的免疫細胞,如T細胞(包括輔助T細胞和細胞毒性T細胞)和自然殺傷(NK)細胞。綜合這些發現表明,SLC1A6與腫瘤進展和免疫抑制性腫瘤微環境的形成相關。
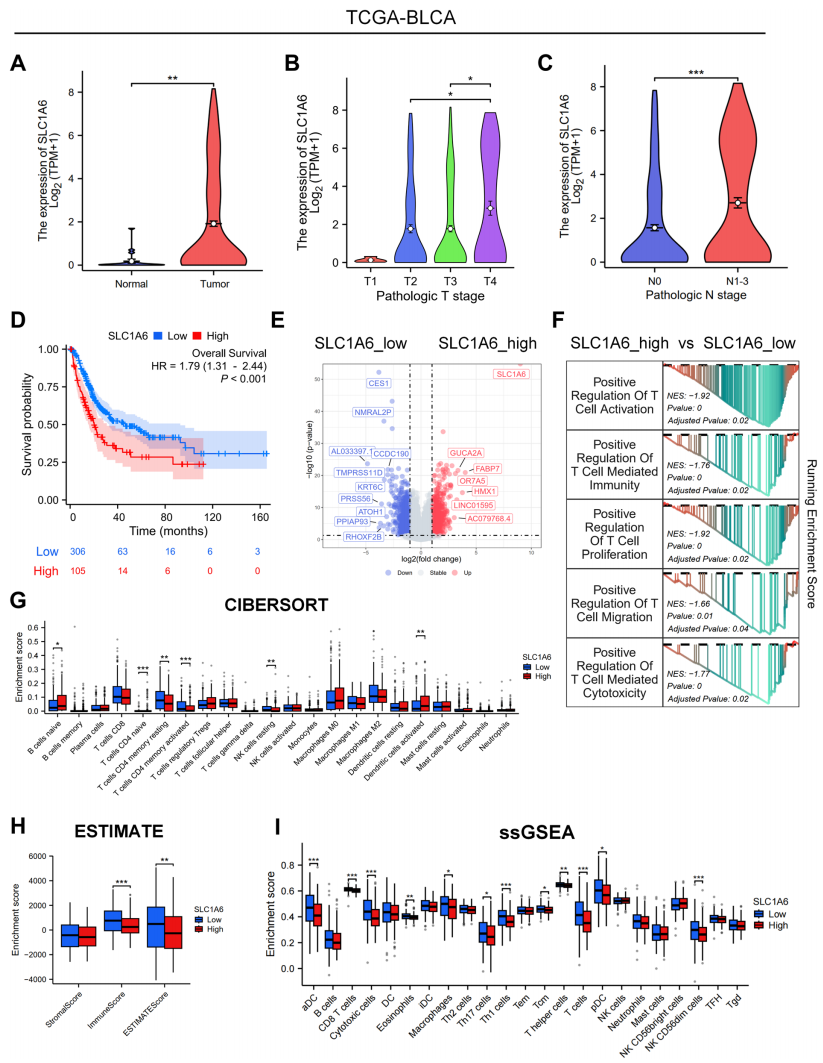
圖 3
4. 腫瘤細胞中的SLC1A6競爭性攝取谷氨酸以降低CD8+ T細胞的效應功能
基于我們之前的分析,我們采用了體外共培養模型來驗證腫瘤細胞中SLC1A6表達對T細胞效應功能的影響。首先,我們在小鼠膀胱癌細胞系MB49中敲低了SLC1A6。接下來,我們測量了MB49 shNC和MB49 shSLC1A6細胞及其培養上清中的谷氨酸水平。MB49 shSLC1A6細胞中的谷氨酸含量降低,而上清中的谷氨酸水平增加(圖4A, B)。這些結果表明,腫瘤細胞的SLC1A6通過促進外源性谷氨酸的攝取,增強了腫瘤細胞的生長和遷移能力。我們推測谷氨酸可能影響T細胞的效應功能。流式細胞術分析顯示,添加外源性谷氨酸增加了GZMB + CD8 + T細胞的比例(圖4C, D)。接下來,我們分別將MB49 shNC和MB49 shSLC1A6細胞的條件培養基添加到原代小鼠T細胞中。流式細胞術分析揭示,與MB49 shNC組相比,MB49 shSLC1A6組中GZMB + CD8 + T細胞的比例更高。此外,向MB49 shNC條件培養基中添加谷氨酸增加了GZMB + CD8 + T細胞的比例(圖4E, F)。上述結果表明,腫瘤細胞的SLC1A6通過競爭性攝取谷氨酸,降低了CD8 + T細胞的效應功能,而外源性谷氨酸的補充和腫瘤細胞中SLC1A6表達的降低均增強了CD8 + T細胞的效應功能。
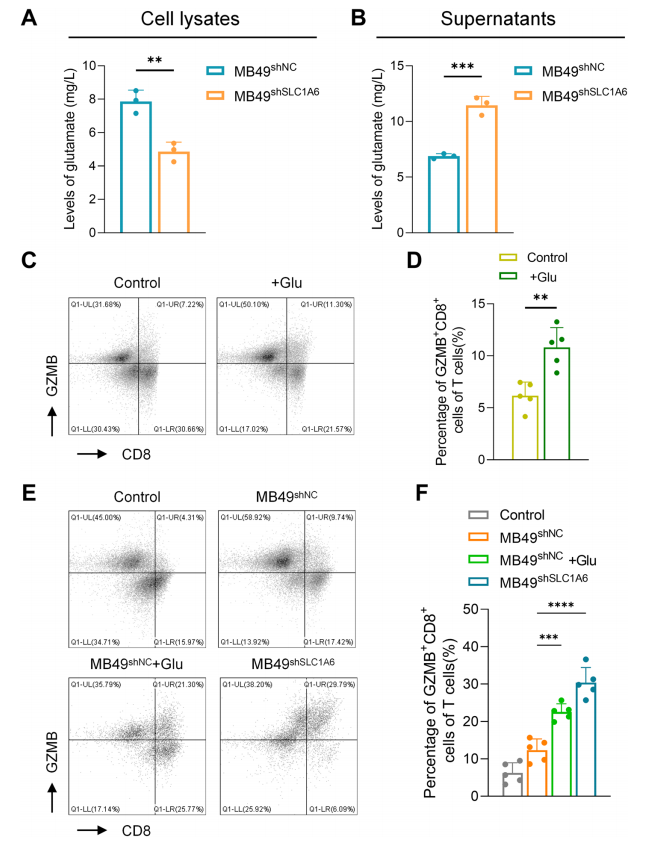
圖 4
5. MB49細胞中SLC1A6的敲低增強了抗-PD-1免疫療法的療效
為了探究SLC1A6敲低對抗-PD-1免疫療法的影響,我們建立了MB49細胞的皮下腫瘤模型。小鼠被注射了MB49 shNC或MB49 shSLC1A6細胞,隨后用抗-PD-1抗體或IgG作為對照進行治療(圖5A)。我們的結果顯示,SLC1A6敲低在一定程度上抑制了腫瘤生長。雖然單獨的抗-PD-1療法在MB49腫瘤模型中表現出部分療效,但SLC1A6敲低與抗-PD-1治療的結合顯著增強了腫瘤的抑制。在LLC小鼠模型中SLC1A6的敲低顯著增強了抗-PD-L1的療效。總之,靶向SLC1A6的抑制與免疫檢查點抑制協同作用,如改善的治療反應指標得到了證明。
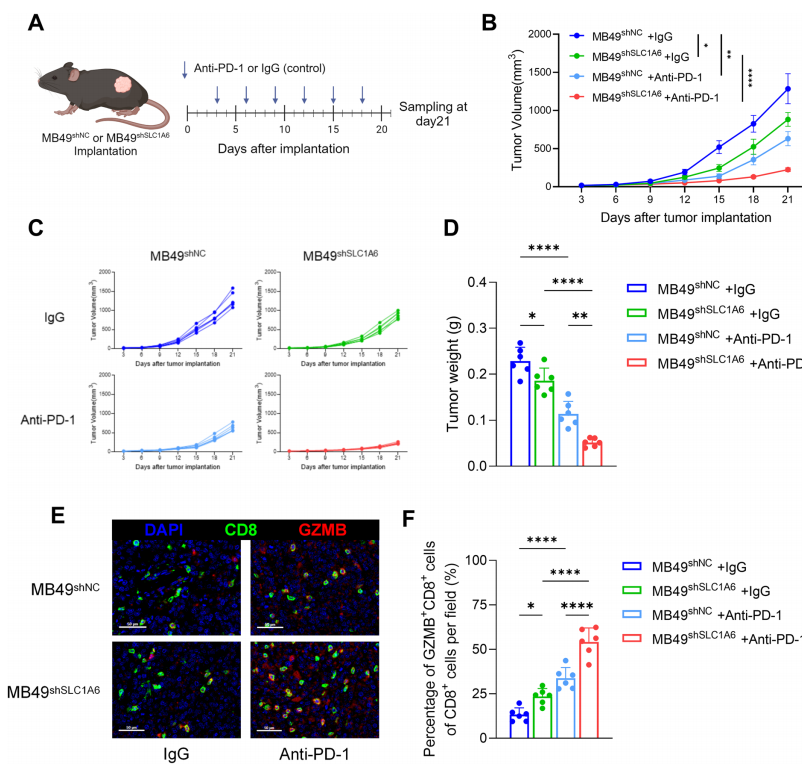
圖 5
結語
除了在中樞神經系統中作為神經遞質的經典作用外,谷氨酸已成為免疫反應和腫瘤免疫治療的關鍵調節因子。盡管已經開發了針對谷氨酸代謝、其轉運蛋白和相關信號通路的靶向治療藥物,但它們在癌癥患者中的臨床療效仍有待完全闡明。隨著我們對谷氨酸信號傳導及其與腫瘤細胞和CD8?T細胞的相互作用的理解不斷深入,靶向調節谷氨酸代謝可能為增強腫瘤免疫治療和改善患者預后提供新的策略。
在這項研究中,我們使用單細胞RNA測序分析確定了谷氨酸轉運蛋白SLC1A6是膀胱癌免疫治療耐藥性的關鍵介質。使用肺癌單細胞數據集以及膀胱癌和肺癌隊列的轉錄組數據進一步驗證了SLC1A6的臨床意義,隨后通過體外和體內功能實驗,證實了其在促進癌癥新輔助免疫治療耐藥性中的作用。據報道,SLC1A6表達的降低與免疫細胞浸潤增加和對免疫檢查點阻斷治療的敏感性提高相關,這與我們的觀察結果一致。未來的研究需要涉及更廣泛的癌癥類型,以確定SLC1A6的免疫調節作用是否在惡性腫瘤中保持一致。在精準腫瘤學的背景下,未來的努力應繼續集中在開發和系統評估針對SLC1A6的治療策略,特別關注其在不同、真實世界臨床環境中的療效和安全性。
總之,我們的研究確定了SLC1A6作為癌癥中的新型生物標志物和潛在治療靶點,為其預后意義提供了寶貴的見解。靶向SLC1A6可能為克服新輔助免疫治療耐藥性提供一種有希望的策略,并促進聯合治療方法的發展,最終改善癌癥的治療效果。
參考文獻:Li C, Lin Y, Zheng H, Zeng H, Xu L, Wu D, Lao J, Cai P, Liang S, Wang C, Lin T, Zhong W. Glutamate transporter SLC1A6 promotes resistance to immunotherapy in cancer. Cancer Immunol Immunother. 2025 Jun 7;74(8):240. doi: 10.1007/s00262-025-04074-4. PMID: 40481876; PMCID: PMC12145344.
伯優®單細胞測序組織保存液
本產品專為人、小鼠等動物新鮮組織樣本的保存和運輸而設計。組織在4°C條件下保存72小時以內,可制備成高活率的細胞懸液,滿足單細胞測序的實驗要求。
