
 期刊:Science immunology
期刊:Science immunology
影響因子:16.3
伯豪技術服務+產品:單細胞測序、伯優®組織樣本懸液制備試劑盒
研究背景
先天淋巴細胞(ILCs)作為天然免疫的關鍵組成部分,在抗感染、免疫調節和組織重塑中發揮核心作用。然而,胚胎期與成體骨髓造血如何時空性貢獻于ILC庫的問題長期存在爭議。本研究通過譜系追蹤、單細胞測序和移植實驗等技術,揭示了 ILCs 的雙起源模式:髓外ILCs起源于胎兒肝臟(FL)產生的 PD-1?ILC 前體(ILCPs),這些前體在胚胎期定植于肺、腸道等外周組織,在局部微環境誘導下分化為雙能 ILC1/ILC3 前體(ILC1/3P)或 ILC2 前體(ILC2P),并終身維持組織 ILC 庫,且不依賴成體骨髓造血;髓內ILC2s主要依賴骨髓造血。該研究首次系統闡明了 ILCs 的發育動力學,為理解天然免疫細胞的胚胎起源與組織維持機制提供了全新框架,對感染、炎癥等疾病的靶向治療具有重要啟示。
關鍵技術
單細胞測序、伯優®組織樣本懸液制備試劑盒
(技術服務及科技產品由伯豪生物提供)
研究結果
1. 胚胎期 ILC 前體的時空出現規律
眾所周知,先天淋巴細胞家族起源于表達α4β7的祖細胞(αLPs),且在 αLP 群體中已發現多種先天淋巴細胞譜系限制性祖細胞。研究首先通過流式細胞術追蹤了胚胎期 α4β7?淋巴樣前體(αLPs,ILCs 的發育前體)的分布。結果顯示,αLPs 最早在 E12.5 的胎兒肝臟中被檢測到,而此時胎兒肺和腸道中尚未出現;E13.5 時,肺和腸道中出現 αLPs,且其中絕大多數為 PD-1?ILCPs(經典 ILC 前體標記)。這一時間差提示,PD-1?ILCPs 可能起源于胎兒肝臟,并隨后遷移至外周組織。
進一步通過 Fgd5 譜系追蹤模型(標記造血干細胞及其后代)證實:E12.5 時胎兒肝臟的造血干細胞(HSCs)被標記后,E18.5 時肝臟、肺和腸道的 ILCPs 均攜帶相同標記,且標記效率與胎兒肝臟 HSCs 一致。這直接證明,外周組織的 ILCPs 均來源于胎兒肝臟 HSCs,而非卵黃囊(YS)等其他胚胎造血位點(卵黃囊中未檢測到 αLPs)。
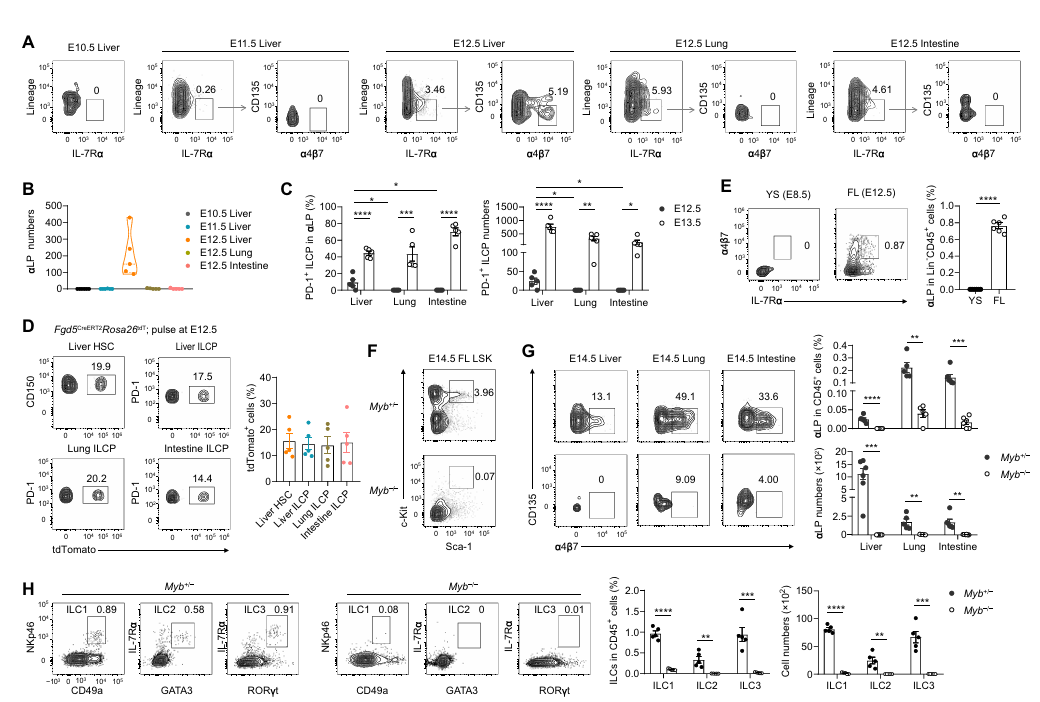
圖1. 胎兒肝臟造血干細胞來源的 ILCP 在胎兒發育期間定植于外周組織
2. 胎兒肝臟 ILCPs 的異質性與發育軌跡
為解析胎兒肝臟 ILCPs 的分子特征,作者對E14.5胎兒肝臟的αLPs進行了scRNA-seq。聚類分析顯示,這些細胞可分為 5 個亞群,其中 C4 亞群高表達 Tcf7、Lef1 等基因,符合早期先天淋巴樣前體(EILPs)特征;C1 亞群表達 Pdcd1(PD-1)、Zbtb16(PLZF)等,為 PD-1?ILCPs;C2 亞群高表達 Klrd1(CD94),后續被證實為雙能 ILC1/3P;C3 亞群表達 Lta、Il22 等,為 ILC3 前體(ILC3P)。
擬時序分析進一步揭示了其發育路徑:EILPs(C4)→PD-1?ILCPs(C1)→CD94?ILC1/3P(C2)→ILC3P(C3),形成連續的分化層級。這一發現不僅明確了胎兒肝臟 ILCPs 的內部結構,還為后續組織特異性分化奠定了基礎。
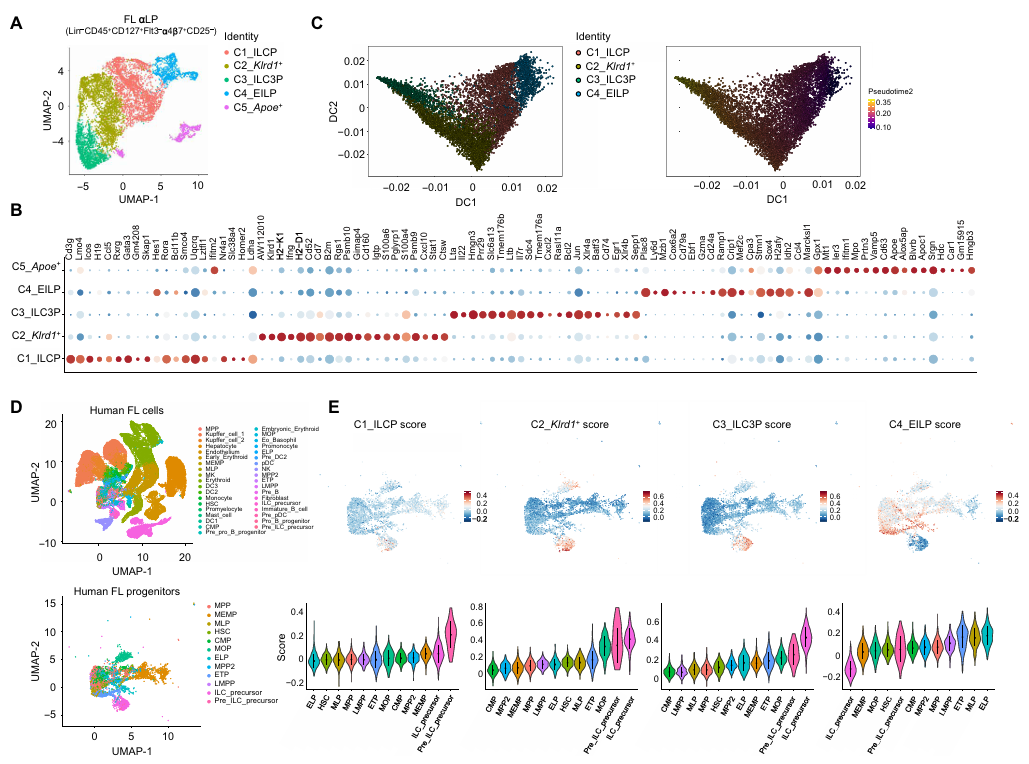
圖2. 胎兒肝臟先天淋巴細胞祖細胞的異質性和發育軌跡
3. CD94 標記雙能 ILC1-ILC3 前體,位于 ILCPs 下游
scRNA-seq 鑒定的 C2_Klrd1?群體(表達 CD94)引起關注。研究發現,胎兒肝臟中部分 αLPs 表達 CD94,這些 CD94?前體多為 CD160?PD-1?,低表達 Zbtb16,高表達 NKG2A、CD49a 等分子,且轉錄因子調控網絡顯示其表達 Tbx21 和 Rorc,可能與 ILC1 和 ILC3 發育相關。通過 Klrd1 命運圖譜模型和體外培養實驗證實,CD94?前體可生成 ILC1 和 ILC3,但不生成 ILC2 和 cNK 細胞,故將其定義為雙能 ILC1-ILC3 前體(ILC1/3Ps)。常規轉錄組測序和功能實驗進一步表明,ILC1/3Ps 的轉錄譜與 ILCPs 更接近,且由 ILCPs 直接分化而來,是 ILCPs 的下游后代。
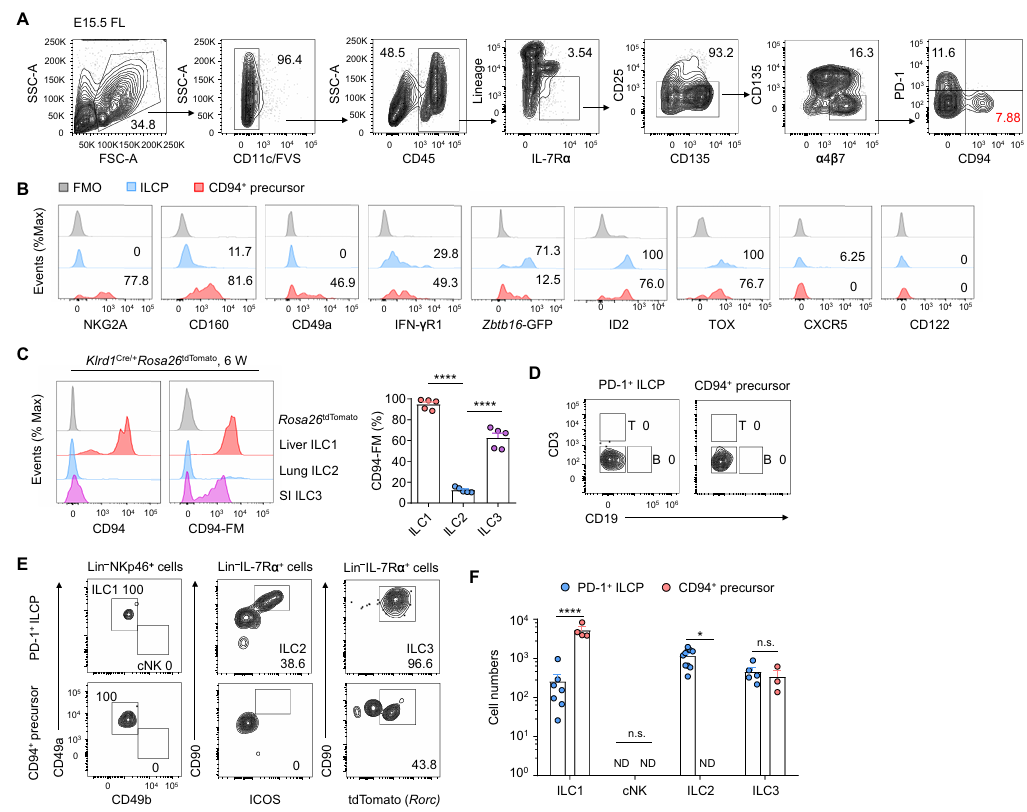
圖3. CD94?前體生成 ILC1 和 ILC3
4. 組織微環境引導 ILCPs 向特定先天淋巴細胞亞群分化
對胎兒至成年期組織中先天淋巴細胞祖細胞的分析顯示,ILCPs 數量在胎兒期或新生兒期達峰,成年后極少;ILC1/3Ps 和 ILC2Ps 的比例因組織而異:肝臟以 ILC1/3Ps 為主,成年后 ILC1 占成熟亞群主導;肺中 ILC2Ps 隨發育增加,成年后 ILC2 占優;腸道中兩種前體均持續存在,ILC3 占成熟亞群 60%。這種前體與成熟細胞的比例匹配,暗示組織微環境的定向調控作用。過繼轉移實驗證實,胎兒肝臟 ILCPs 在肝臟中主要分化為 ILC1,在肺中為 ILC2,在腸道中則涵蓋所有亞群;而 ILC1/3Ps 僅能生成 ILC1 和 ILC3,失去 ILC2 潛能。這表明組織微環境決定了 ILCPs 的分化偏好。
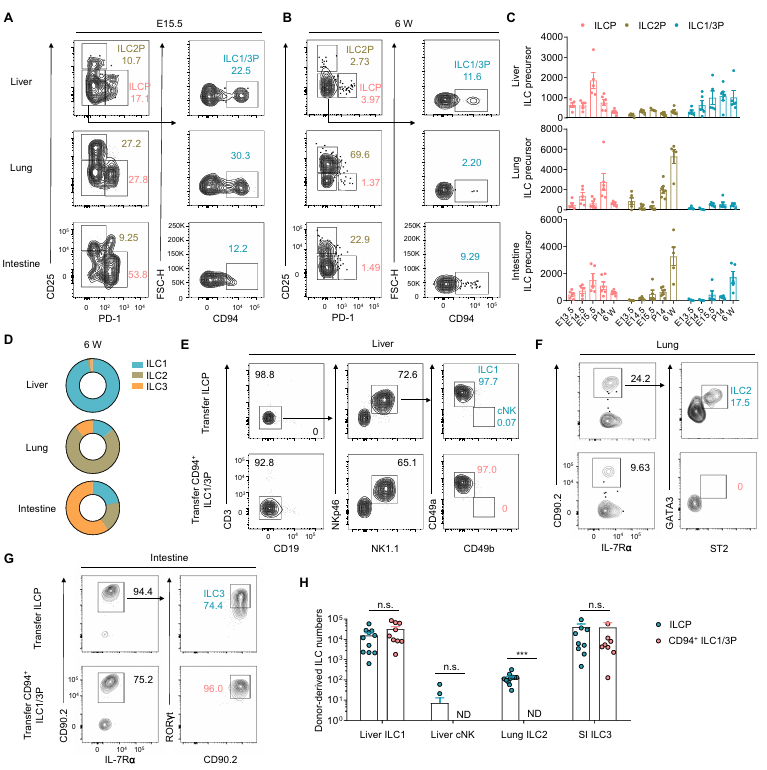
圖4. 不同的組織微環境促使 ILCP 生成不同的先天淋巴細胞亞群
5. 多數外周先天淋巴細胞的發育與擴增不依賴骨髓造血
出生后骨髓雖為主要造血器官,但對先天淋巴細胞的貢獻有限。Fgd5 命運圖譜分析顯示,成年后外周組織 ILC1/3Ps、ILC2Ps 及成熟先天淋巴細胞的骨髓來源標記率極低,歸一化后超 80% 的髓外先天淋巴細胞起源于胚胎前體,與骨髓無關。骨髓移植實驗也證實,供體骨髓僅能重建 30% 的 cNK 細胞,對 ILC1、ILC2、ILC3 的重建率僅 2%~6%。
病理狀態下,LCMV 感染、IL-33 誘導的肺炎癥及檸檬酸桿菌感染均會誘導組織內 ILC 前體局部增殖(如肝臟 ILC1/3Ps 增殖率從 10.7% 升至 15.8%),而非依賴骨髓來源的新細胞,進一步證實外周先天淋巴細胞的自主維持特性。

圖5. 外周先天淋巴細胞的發育不依賴骨髓造血干細胞
6. 骨髓造血對髓內 ILC2 發育至關重要
與髓外不同,骨髓中先天淋巴細胞祖細胞以 ILC2Ps 為主(占 97.2%),scRNA-seq 顯示 pre-ILC2Ps 在骨髓中顯著富集。命運圖譜分析表明,骨髓 ILC2Ps 和成熟 ILC2s 的標記率與骨髓 HSCs 一致(超 60%),歸一化后超 80% 的骨髓 ILC2s 由髓內造血生成,而外周 ILC2s 中骨髓來源不足 20%。這表明骨髓造血主要支持髓內 ILC2s 的發育,可能與骨髓脂肪微環境的調控有關。
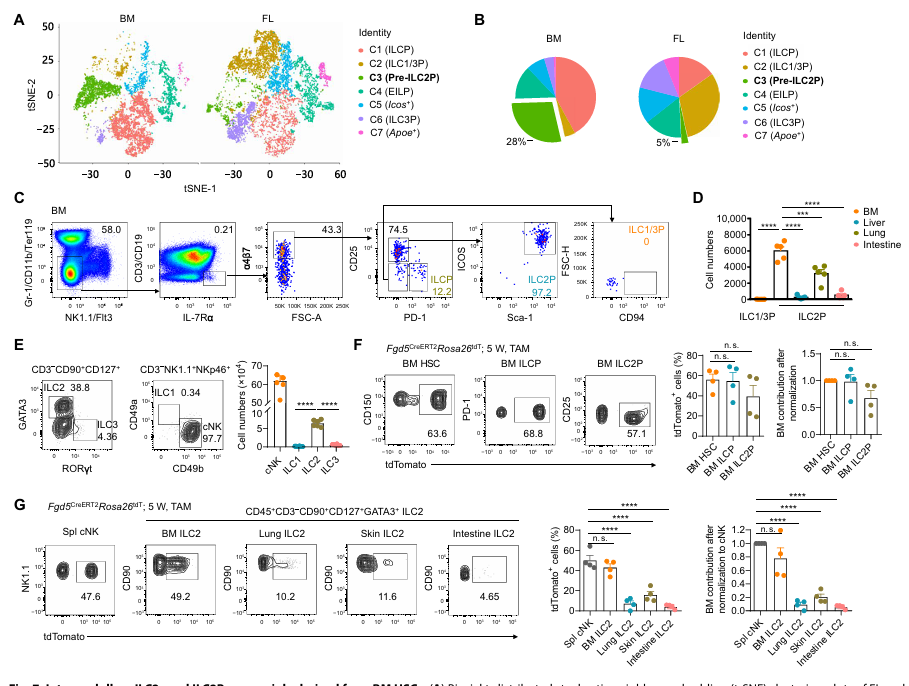
圖6. 骨髓內 ILC2 和 ILC2 前體主要來源于骨髓造血干細胞
參考文獻:
[1] Wang X, Li J, Rebuffet L, Cheng M, Bao B, Chen Y, Zheng X, Chen Y, Sun H, Sun R, Vivier E, Peng H and Tian Z 2025 Innate lymphoid cells originate from fetal liver-derived tissue-resident progenitors Sci Immunol 10 eadu7962
伯優®組織樣本懸液制備試劑盒
本產品適用于多種組織樣本的單細胞懸液制備。組織樣本預處理后利用酶溫和、快速、有效地破壞細胞外基質,釋放細胞,經過篩、離心等標準化操作流程,生成高質量的單細胞懸液。實驗操作簡單便捷,不需要特別的解離儀器,可輕松實現多種組織的解離。制備的單細胞懸液可用于單細胞測序、細胞培養或其他細胞相關檢測。
本產品適用于胃、腎、肺、心臟、肝、腸、甲狀腺、胸腺、食管、鼻組織、皮膚、黏膜、胚胎、淋巴、睪丸、乳腺、卵巢、腫瘤組織等樣本(軟骨、硬骨、脂肪、胰腺、腦組織除外)。
