
期刊:Advanced science
影響因子:14.1
伯豪技術服務+產品:轉錄組測序、單細胞轉錄組測序、伯優®單細胞測序組織保存液
研究背景
腫瘤微環境(TME)對癌癥預后和療效有重要影響,但其組成具有高度異質性,目前尚無一種普適性的高通量方法對其進行定義。本研究開發了TMEclassifier,一種機器學習工具,可將癌癥分為三種不同亞型:免疫排斥型(IE)、免疫抑制型(IS)和免疫激活型(IA)。通過bulkRNA測序可根據TME亞型對患者樣本進行分類,體內小鼠模型驗證了TME亞型的差異以及對免疫治療的不同響應。IE亞型的特征是基質細胞豐度高,與侵襲性癌癥表型相關;IS亞型以髓系來源抑制細胞浸潤為特點,加劇免疫抑制; IA亞型常與EBV(Epstein-Barr病毒)/MSI(微衛星不穩定)相關,表現出T細胞富集及更好的免疫治療響應。本研究應用單細胞RNA測序探索TME的細胞異質性,體內實驗表明,靶向IL-1(白細胞介素-1)可抵消IS亞型的免疫抑制作用,并顯著提高其對免疫治療的敏感性。TMEclassifier的預測在該前瞻性胃癌隊列(TIMES-001)及其他多種隊列中得到了驗證。這種分類工具能夠有效對患者進行分層,為個性化免疫治療策略提供指導,從而提高治療精準度。
主要技術
轉錄組測序、單細胞轉錄組測序、
伯優®單細胞測序組織保存液
(技術服務及科技產品由伯豪生物提供)
研究結果
1. TME亞型分類模型的構建與驗證
作者基于亞洲癌癥研究組(ACRG)胃癌隊列的基因表達數據,通過CIBERSORT和MCP-counter工具估算23種腫瘤微環境(TME)細胞的浸潤水平,經無監督聚類分析識別出三種穩定的TME亞型:免疫排斥型(IE)、免疫抑制型(IS)和免疫激活型(IA)。為實現高效且可重復的分類,作者通過成對差異表達基因(DEG)分析篩選出134個亞型特異性特征基因(IE:40個,IS:19個,IA:75個),并采用支持向量機(SVM)、隨機森林(RF)、神經網絡(NNET)等6種機器學習算法,在ACRG隊列的訓練集(75%樣本)和驗證集(25%樣本)中構建集成模型(TMEclassifier)。結果顯示,該模型在訓練集的準確率達94%(Kappa值90%),驗證集準確率82%(Kappa值74%),可穩定區分三種亞型。后續將其應用于1992例胃癌樣本及多個癌癥隊列,結合bulk-seq和單細胞RNA-seq數據,進一步驗證了該模型對TME特征、信號通路及細胞相互作用的區分能力,為后續分析奠定了可靠基礎。
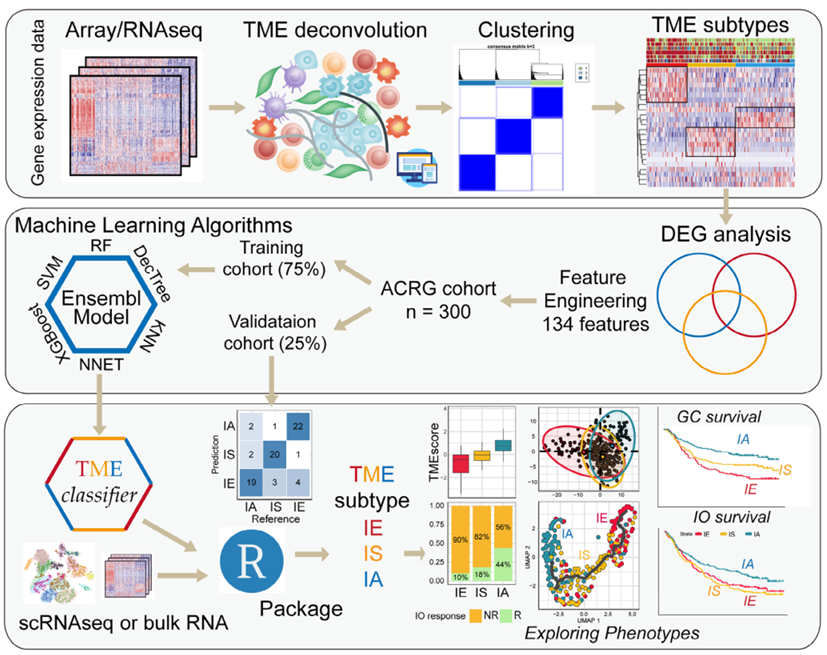
圖1 TMEclassifier 構建和TME亞型特異性分析的工作流程
2. TME亞型與臨床特征及生存結局的關聯
在ACRG隊列中,三種TME亞型呈現顯著的臨床和分子差異。臨床特征方面,IE亞型多為晚期(AJCCIII/IV期占72%),以彌漫型Lauren分型為主(64%),且與上皮-間質轉化(EMT)亞型高度相關;IA亞型多為早期(I/II期占59%),與微衛星不穩定(MSI)和EBV感染腫瘤(合計56%)高度相關。生存分析顯示,IA亞型預后最佳,IE最差,IS居中,且該趨勢在TCGA-STAD、GSE84437等多個隊列中一致。輔助治療(放化療)可顯著改善IE和IA患者的總生存期(p<0.001),但對IS患者無顯著獲益(p=0.25),提示IS存在固有耐藥性。分子特征方面,IA亞型腫瘤突變負荷(TMB)最高,免疫檢查點基因(如CD274、PDCD1)及效應CD8?T細胞功能基因(如CD8A、GZMB)表達顯著上調,表現更強的抗腫瘤免疫活性;IE亞型TMB最低,在EMT和基質相關通路富集。免疫治療響應方面,IA亞型TMEscore(反映免疫浸潤水平)最高,對免疫檢查點阻斷(ICB)治療的敏感性顯著高于IE和IS,而傳統標志物PD-L1CPS在該隊列中無法有效區分治療響應。
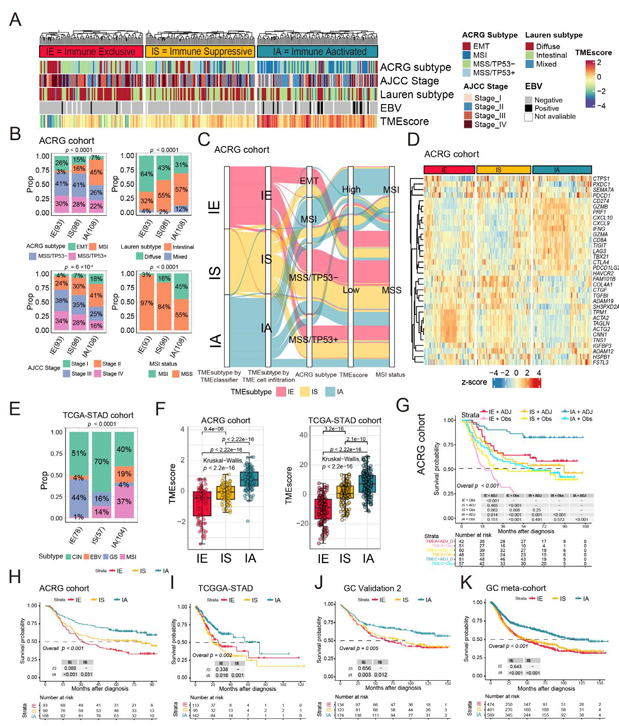
圖2 TME亞型與臨床特征、免疫治療療效生物標志物和生存結局的關系
3. TME亞型的細胞浸潤模式及進化關系
通過bulk RNA和單細胞RNA-seq數據分析三種亞型的細胞浸潤特征,結果顯示三者之間有顯著差異。IE亞型中癌癥相關成纖維細胞(CAFs)、內皮細胞、M2型巨噬細胞及靜息樹突狀細胞顯著富集,形成“免疫排斥”微環境,阻礙免疫細胞浸潤;IS亞型以中性粒細胞、M0型巨噬細胞、活化肥大細胞等髓系細胞浸潤為主(髓系細胞占比21.97%),CD8?T細胞浸潤最少,呈現“免疫抑制”表型;IA亞型高浸潤CD8?T細胞、M1型巨噬細胞、活化記憶CD4?T細胞,具有強抗腫瘤活性,形成“免疫激活”微環境。單細胞數據進一步證實: IA中T-NK細胞富集(占比50.92%),髓系細胞在IS中占比最高,內皮細胞和成纖維細胞在IE中更活躍。擬時序分析提示三種亞型可能存在進化關系:從IA逐漸向IS、IE轉化,為通過靶向干預逆轉耐藥微環境提供了理論基礎。
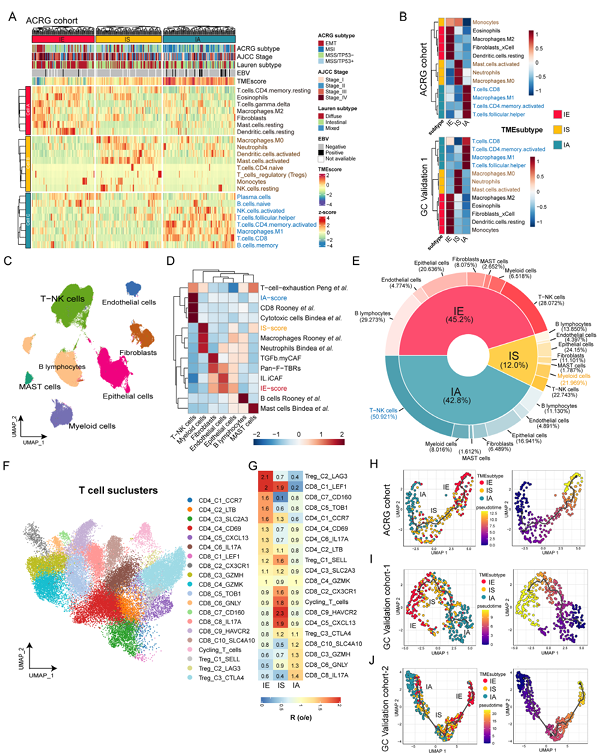
圖3 三種TME亞型的腫瘤微環境景觀和動態演化
4. IL-1/IL-1R1信號通路在IS亞型免疫抑制中的作用
機制研究發現,IS亞型中IL-1/IL-1R1信號通路上調是導致免疫抑制和ICB耐藥的關鍵。表達特征上,IS亞型中IL-1α/β(配體)和IL-1R1(受體)表達顯著升高,且與髓系來源抑制細胞(MDSC)浸潤、T細胞耗竭呈正相關,與CD8?T細胞浸潤呈負相關。細胞間通訊分析顯示,IL-1/IL-1R1是IS亞型中最主要的配體-受體相互作用,通過招募髓系細胞和激活成纖維細胞,形成免疫抑制正反饋循環。動物實驗驗證:在IS亞型小鼠模型(YTN5細胞系)中,聯合使用IL-1R抑制劑與抗PD-1抗體可顯著增加CD8?T細胞和M1巨噬細胞浸潤,激活細胞毒性T淋巴細胞分泌細胞因子,逆轉ICB耐藥,腫瘤殺傷效果提升約2倍。
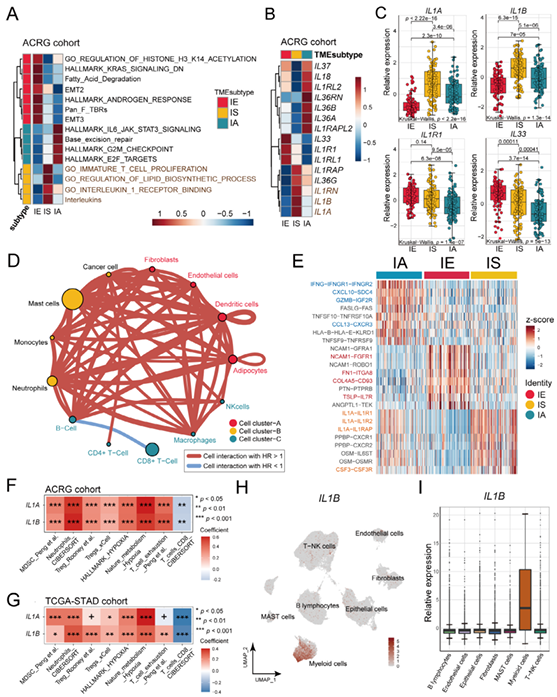
圖4 TME亞型與IL-1/IL-1R1及其他生物學特征的關系
5. TME亞型作為跨癌種免疫治療響應預測標志物的驗證
在多個獨立隊列中,TMEclassifier的預測價值得到驗證。胃癌隊列中,TIMES-001前瞻性試驗(n=93)顯示,IA亞型患者接受ICB聯合化療的無進展生存期(PFS)顯著長于IE/IS(p<0.001),且模型預測準確性(AUC=0.75)優于PD-L1CPS(AUC=0.63)和TIDE評分(AUC=0.58)。跨癌種驗證中,在尿路上皮癌(IMvigor210隊列)、肝細胞癌(GO30140+IMbrave150隊列)和非小細胞肺癌(OAK+POPLAR隊列)中,IA亞型均與更高的ICB響應率和更長的生存期相關,而IS亞型普遍對免疫治療和化療耐藥。結合TMEclassifier與TMEscore(高TMEscore且為IA亞型的患者響應率達62.5%)可進一步提升預測準確性,為臨床治療決策提供更精準的依據,凸顯了TME亞型分類在個性化免疫治療中的重要價值。
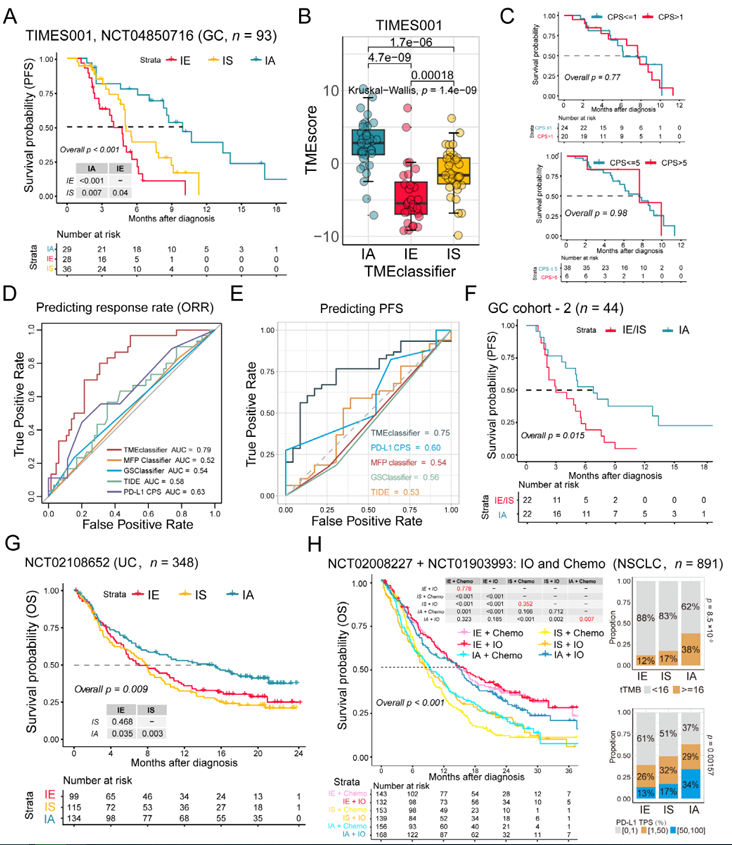
圖5 TME分型作為胃癌和其他腫瘤類型免疫治療響應預測生物標志物的驗證
參考文獻:
Zeng D, Yu Y, Qiu W, Ou Q, Mao Q, Jiang L, Wu J, Wu J, Luo H, Luo P, Gu W, Huang N, Zheng S, Li S, Lai Y, Huang X, Fang Y, Zhao Q, Zhou R, Sun H, Zhang W, Bin J, Liao Y, Yamamoto M, Tsukamoto T, Nomura S, Shi M and Liao W 2025 Immunotyping the Tumor Microenvironment Reveals Molecular Heterogeneity for Personalized Immunotherapy in Cancer Adv Sci (Weinh) 12 e2417593.
伯優®單細胞測序組織保存液專為人、小鼠等動物新鮮組織樣本的保存和運輸而設計。組織在4°C條件下保存72小時以內,可制備成高活率的細胞懸液,滿足單細胞測序的實驗要求。
