前言
腎臟疾病是全球性健康問題,影響著眾多人群。近年來,基于人類多能干細胞(hPSC)的腎臟類器官技術為腎臟研究帶來了新的希望,但仍存在空間模式化不足、成熟度低等問題,限制了其在疾病建模和再生醫學中的應用。
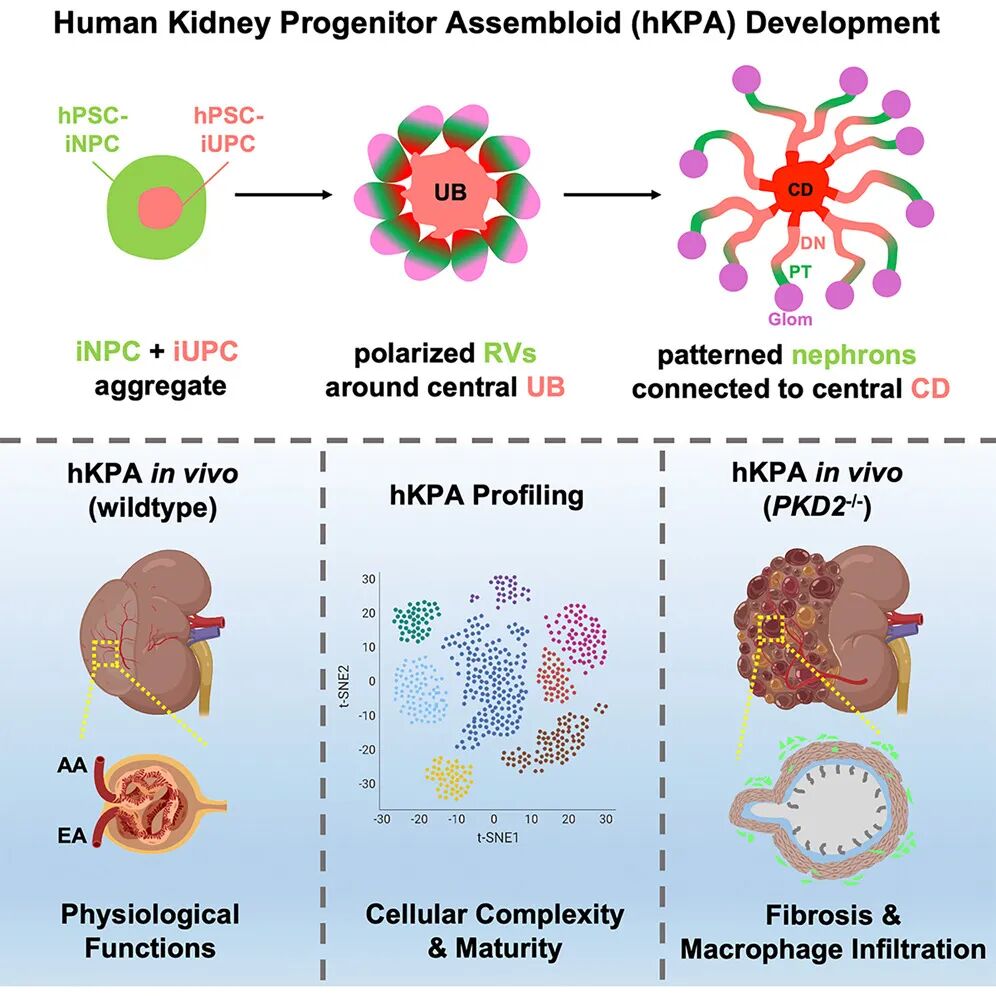
腎臟由超過30種不同類型的細胞組成,這些細胞在腎臟的連續管狀網絡中分化并執行多種生理功能。具體而言,生理條件下,腎臟的形成依賴于幾種腎祖細胞之間的相互作用,其中SIX2+腎祖細胞(NPCs)和WNT11+輸尿管祖細胞(UPCs)的相互作用是腎臟發育的基礎。NPCs生成腎單位,而UPCs分化形成收集管(CD)網絡。盡管已有研究嘗試通過混合不同類型的腎祖細胞來生成類器官,但這些結構仍然缺乏成熟的腎臟功能。因此,開發具有復雜空間模式化和成熟功能的腎臟類器官模型是當前研究的重點。
2025年9月17日,南加州大學李中偉及合作團隊在期刊Cell Stem Cell發表論文“Spatially patterned kidney assembloids recapitulate progenitor self-assembly and enable high-fidelity in vivo disease modeling”,成功開發出一種空間模式化的腎臟組裝體(KPAs),能夠在體外乃至體內重現腎臟前體細胞的自組織過程,形成與天然腎臟高度相似的結構和功能。移植體內后,KPAs可與小鼠的血液循環系統無縫對接并繼續生長、發育并形成具有功能的腎臟結構,表現出良好的血管化和尿液生成能力。這不僅解決了類器官長期停留在“半成熟狀態”的難題,也首次為復雜腎病的高保真建模提供了切實可行的平臺。

01 從類器官到“組裝體”
現有的腎臟類器官模型大多依賴單一前體細胞群體,比如利用SIX2陽性的腎單位前體細胞(NPCs)生成腎單位,或通過尿管芽前體細胞(UPCs)發育出集合管網絡。雖然這些模型揭示了腎臟發育的局部過程,但由于缺乏不同前體細胞之間的相互作用,它們始終無法形成真正成熟的空間格局。李中偉團隊抓住了一個關鍵:在胚胎發育中,腎臟的復雜結構源自不同前體細胞群體的互作——NPCs生成腎單位,UPCs形成集合管,間質祖細胞(IPCs)和血管祖細胞(VPC)則提供支持。研究者推測,只有將這些多種前體細胞以接近天然的方式匯聚,才能觸發真正的“自組裝”過程。
在此基礎上,團隊提出了“腎臟組裝體”的概念。不同于傳統的類器官單一分化,組裝體通過將人類多能干細胞衍生的iNPCs與iUPCs在優化的培養體系中共培養,誘導它們自發組織成具有空間分區的腎臟微型結構。這種策略相當于在培養皿中重現了胚胎腎臟發育的“對話邏輯”,讓細胞自己找到屬于它們的“位置”。
02 實驗設計:從小鼠到人類
研究首先在小鼠體系中進行驗證。通過改良的“v2培養基”,小鼠NPCs與UPCs能夠在三周左右的時間里自發形成包含約150個腎單位的三維結構,即小鼠KPA(mKPA)。所有腎單位不僅展現出近曲小管、亨利袢、遠曲小管等分段特征,還能與中央集合管網絡相連,形成類似天然腎臟的連續管道。尤其值得注意的是,類器官中展現出了典型的維生素D代謝、促紅細胞生成素分泌等內分泌功能,這些都是此前人類腎臟類器官無法實現的生理特征。
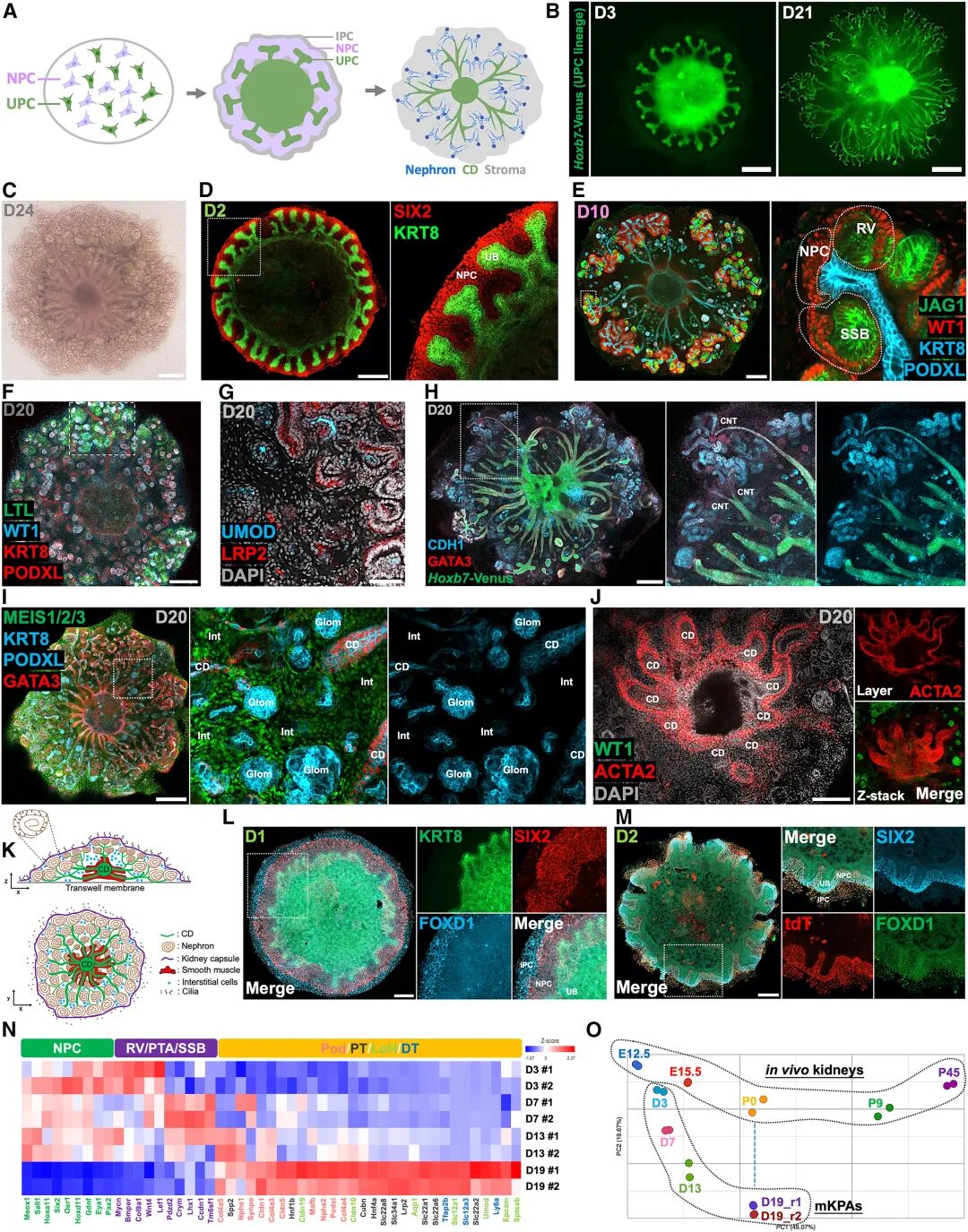
圖 :由可擴展的 NPC 和 UPC 組裝成 小鼠KPA(mKPA)
在人類體系中,研究團隊進一步建立了“v3培養基”(在v2基礎上縮短了FGF9的處理時間,并添加了激素氫化可的松21-半琥珀酸酯(HCHS)和A83-01),并在其中成功組裝了空間模式化的人源腎臟組裝體(hKPAs)。這些hKPAs同樣形成了極化的腎泡,逐步分化為分節的腎單位,并與中央集合管對接。此外,尤其值得注意的是,該培養方案具有高度可重復性,在多個iPSC系中均能建立。
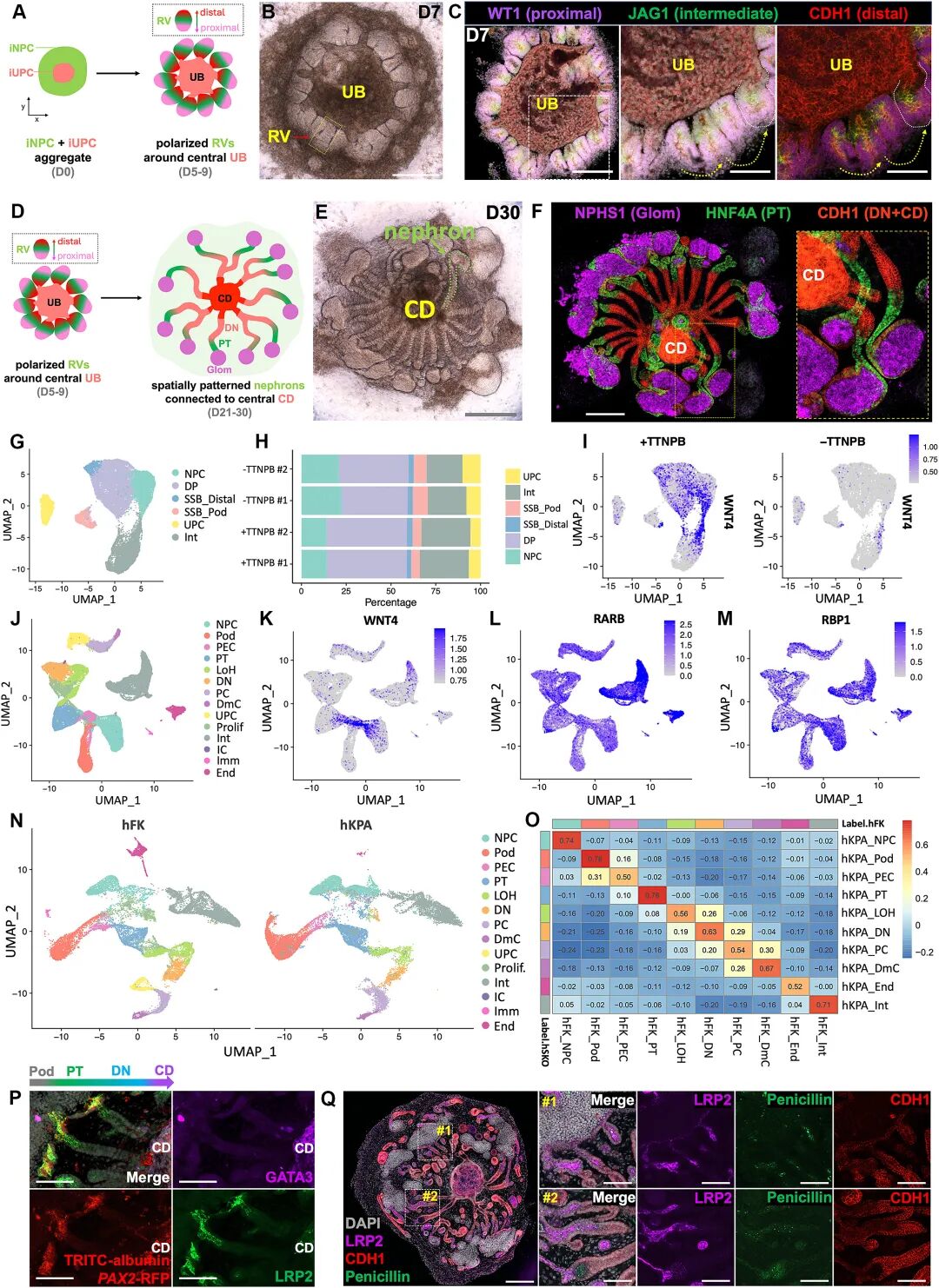
圖:iNPC 和 iUPC 的空間模式化 hKPA 組裝
03 核心突破:空間格局與功能成熟
通過單細胞組學和多組學聯合分析,研究團隊證實,這些組裝體在轉錄譜和染色質開放狀態上都高度接近新生鼠腎臟和17周的人類胎兒腎臟。
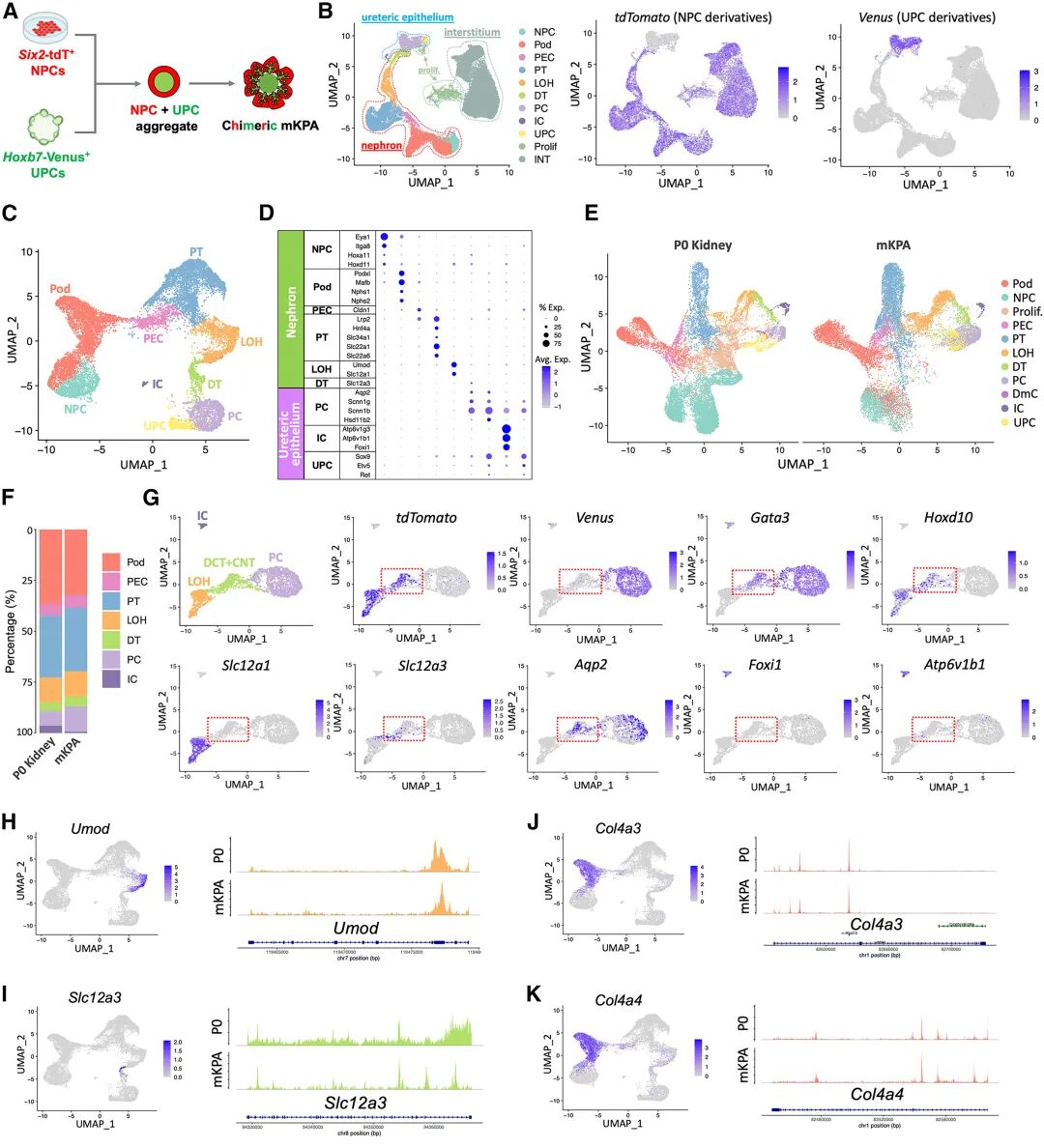
圖:mKPAs 的單細胞多組學分析
相比傳統類器官,KPAs不僅包含集合管細胞類型,還在代謝通路上表現出更強的氧化磷酸化能力,提示能量代謝向成熟腎小管靠攏。移植到小鼠體內后,hKPAs表現出進一步的成熟,形成了人源性血管、間質和腎小球結構,展現了真正的灌注和濾過功能。
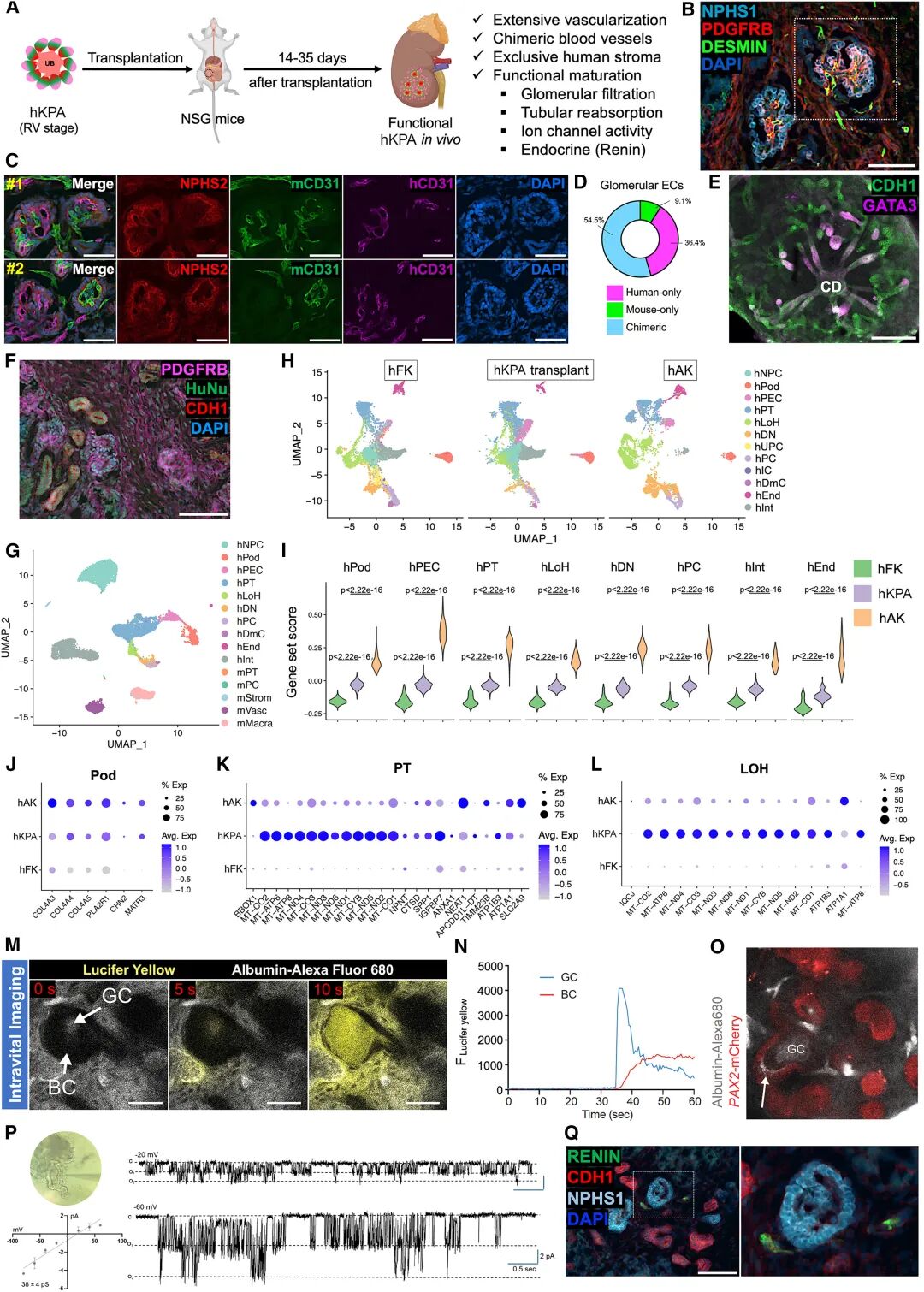
圖:體內移植后功能性hKPA的生成
這種成熟度的提升帶來了關鍵意義:它不僅僅是“結構像”,更是“功能像”。過去的腎臟類器官常被詬病停留在胚胎早期,無法模擬成人期疾病。而KPAs在體內環境中展現的功能,使其成為一個能夠跨越“發育—疾病—再生”全鏈條的研究平臺。
04 疾病建模:ADPKD的高保真復現
為了驗證平臺的應用潛力,研究團隊選擇了最常見的遺傳性腎病——常染色體顯性多囊腎病(ADPKD)。結果顯示,基因編輯后(PKD2-/- hKPAs)的組裝體不僅在兩個月內生長至接近宿主腎臟的體積,還出現了典型的囊性結構,囊液中肌酐和尿素濃度顯著升高,與患者表現高度一致。更重要的是,PKD2-/- hKPAs中觀察到囊上皮極性的喪失、周圍基質細胞的纖維化以及巨噬細胞浸潤,這些復雜的細胞間互作是現有體外類器官模型完全無法再現的。
單細胞測序進一步揭示了PKD2-/- hKPAs中關鍵致病通路的激活,包括cAMP、PI3K/AKT、mTOR以及Wnt信號,同時氧化磷酸化水平顯著下降。這些分子特征與患者樣本高度吻合,為闡釋疾病機制和尋找潛在靶點提供了窗口。
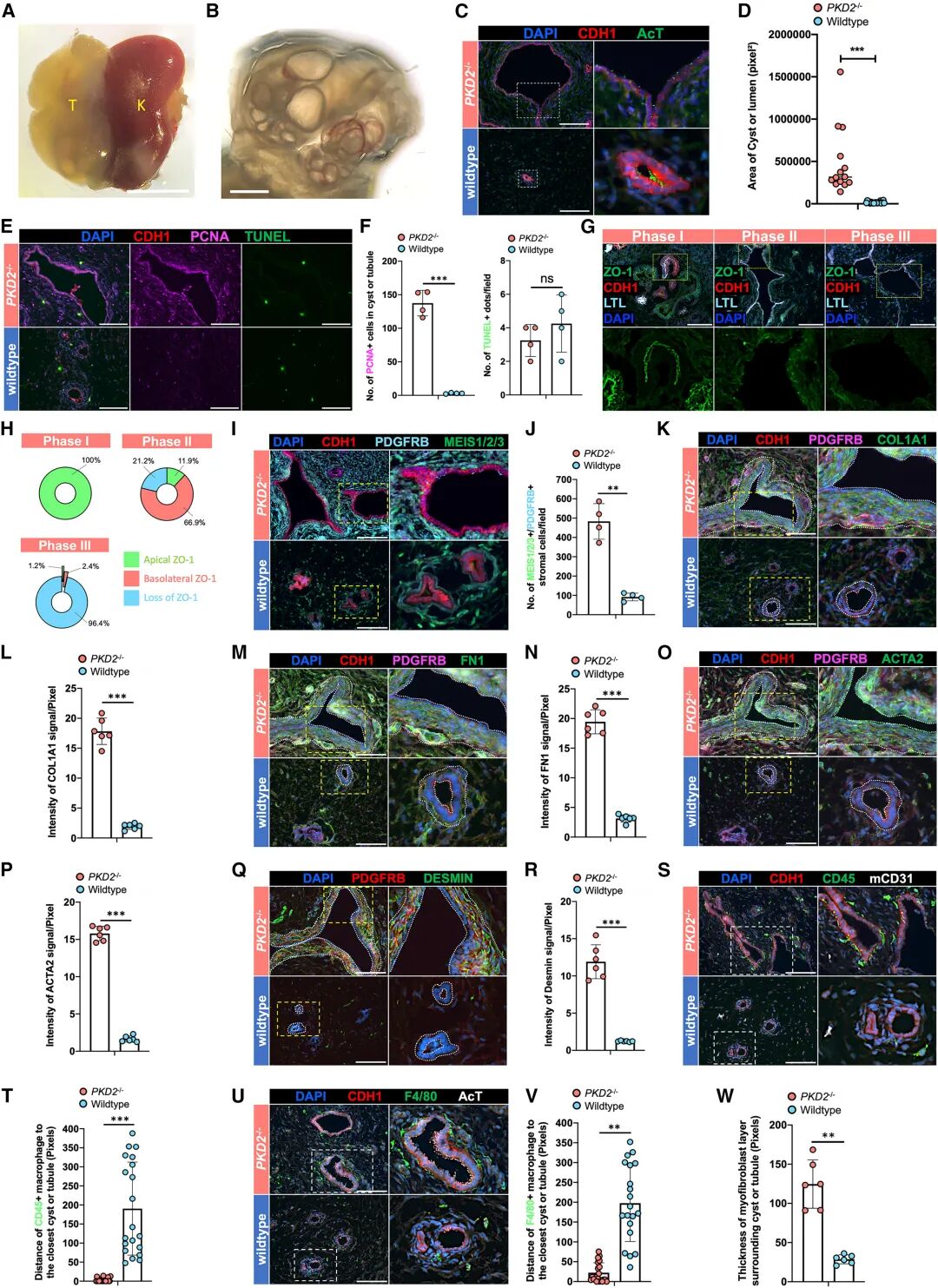
圖:人類 ADPKD 與PKD2−/− hKPA的高保真體內模型
05 總結
本研究重要性在于,它為腎臟疾病研究打開了全新的可能性。空間模式化的組裝體不僅能真實反映復雜疾病的進展過程,也能成為藥物篩選和療效預測的高保真平臺。在再生醫學領域,這種策略更為人造腎臟的構建提供了堅實基礎。通過不斷優化培養體系與前體細胞的互作模式,未來或許能夠在實驗室中生成具備完整功能的腎臟,用于替代衰竭的器官。
近岸蛋白相關產品
近岸蛋白提供多種類器官體外培養全方案,包括基質膠、培養基、相關細胞因子等:
經類器官培養驗證的完全培養基
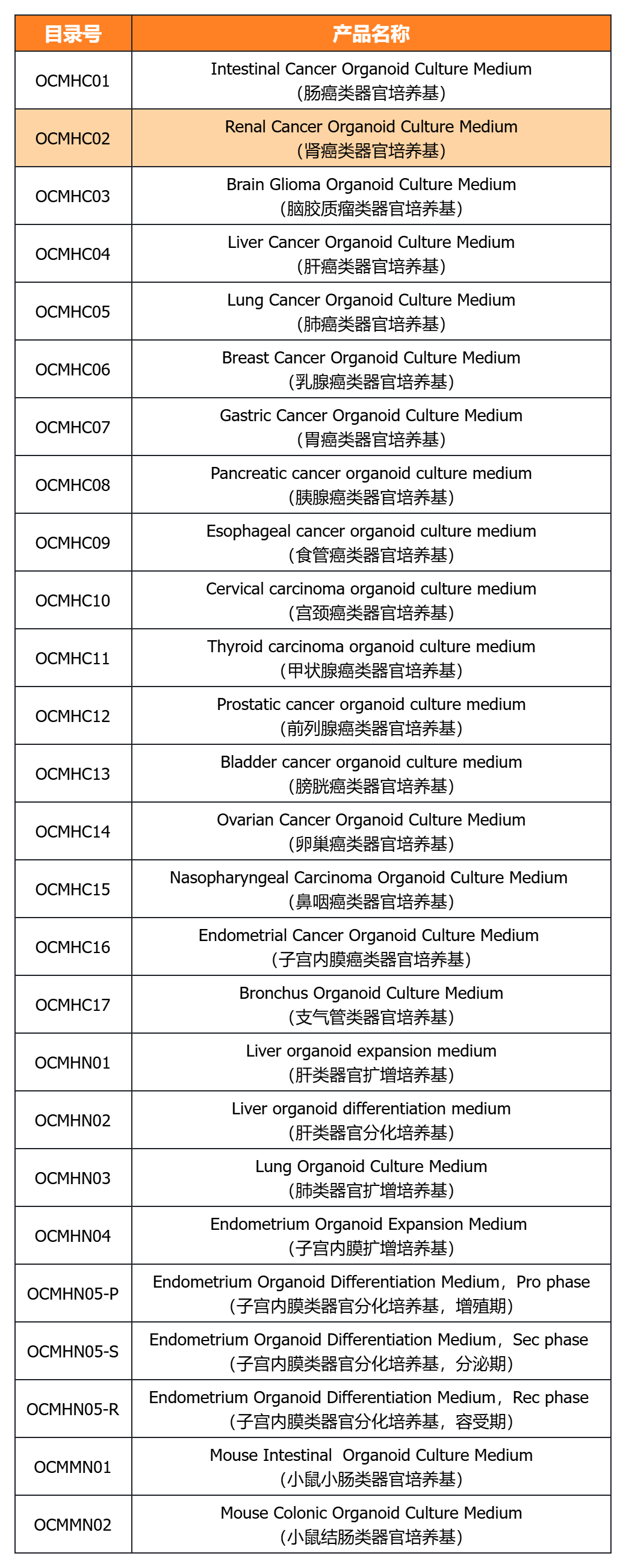
經類器官培養驗證的細胞因子
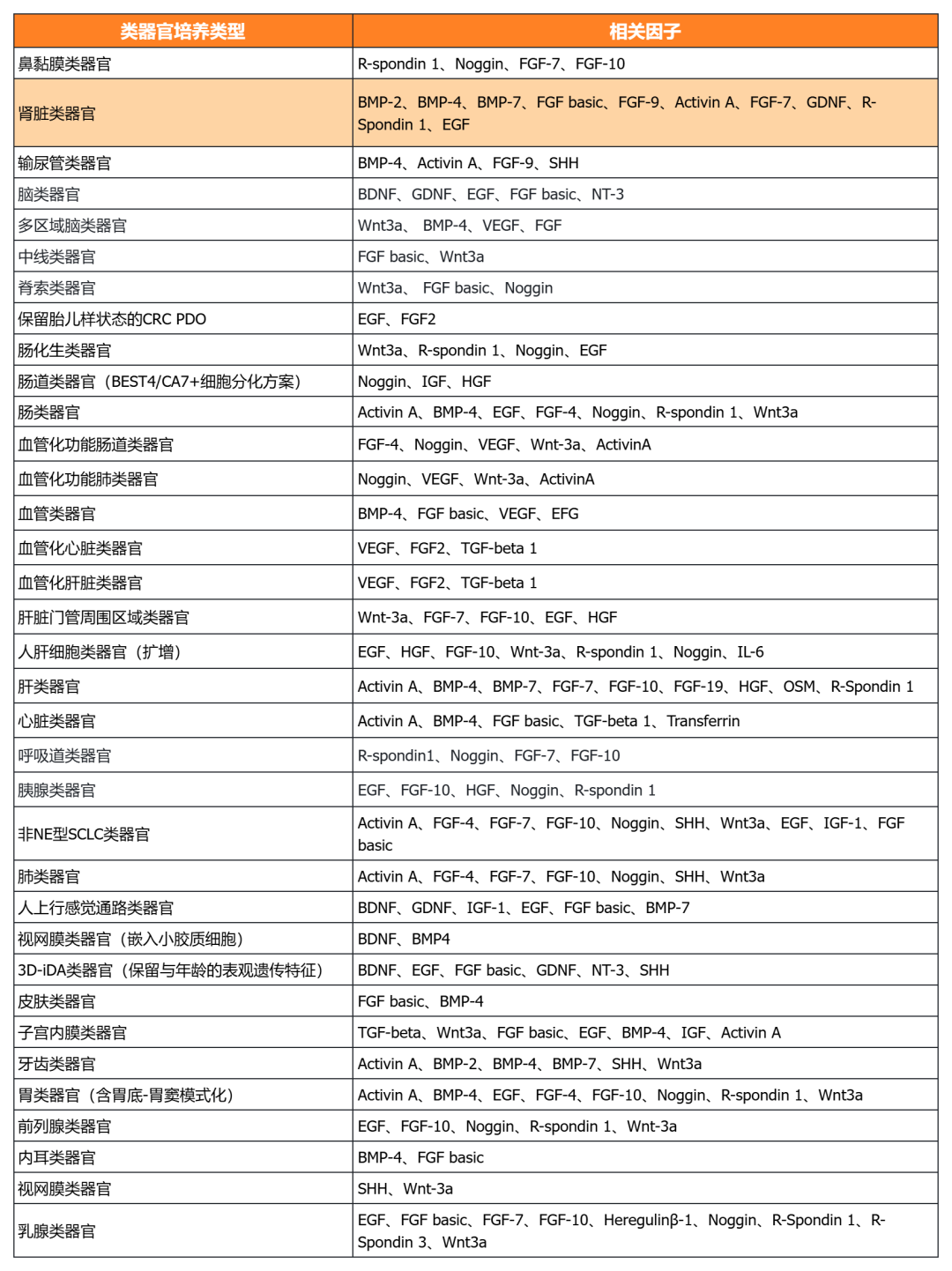
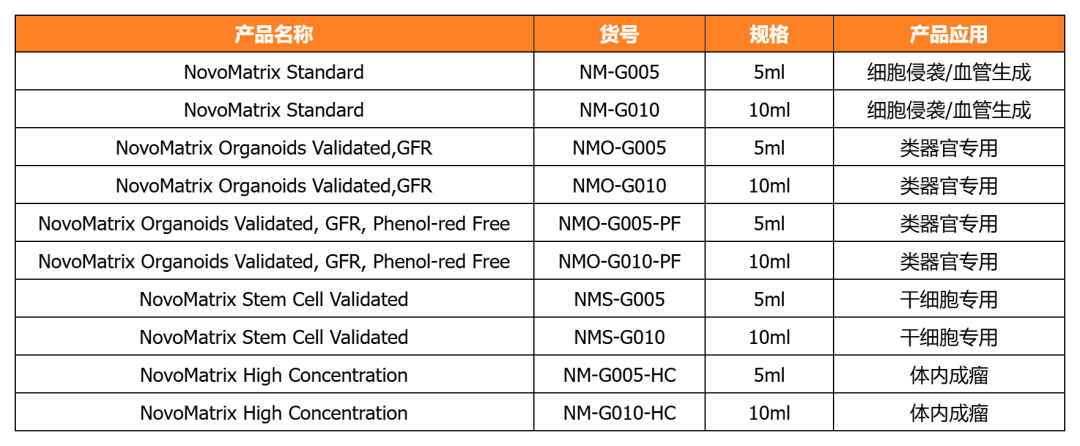
NovoMatrix 基質膠
參考資料
Huang B, Medina P, He J, et al. Spatially patterned kidney assembloids recapitulate progenitor self-assembly and enable high-fidelity in vivo disease modeling. Cell Stem Cell. Published online September 17, 2025. doi:10.1016/j.stem.2025.08.013
