前言
腸道上皮作為人體與腸道內(nèi)容物之間的第一道屏障,其完整性對阻止病原與有害分子進(jìn)入至關(guān)重要。為維持組織穩(wěn)態(tài),上皮細(xì)胞持續(xù)自我更新:新生細(xì)胞自隱窩涌出,沿絨毛軸向上遷移,最終在絨毛頂端被外排或擠出(extrusion)腸腔,完成生命周期的“有序清退”。這一過程長期伴隨一個關(guān)鍵疑問——為何細(xì)胞會在特定的位置與時機(jī)“選擇離開”?流行的解釋強(qiáng)調(diào)局部過度擁擠所致的壓力,但該模型缺乏直接證據(jù),尤其受限于對哺乳動物腸道內(nèi)部力學(xué)與細(xì)胞動態(tài)的原位、長時程解析能力。
細(xì)胞擠出如何被觸發(fā)與執(zhí)行,直接關(guān)系到腸上皮穩(wěn)態(tài),以及外排障礙在炎癥性腸病與簇狀腸病等病理中的作用機(jī)制。2025年9月4日,烏德勒支大學(xué)Hans Clevers團(tuán)隊(duì)與洛桑聯(lián)邦理工學(xué)院、荷蘭AMOLF研究所Oncode研究所及荷蘭代爾夫特理工大學(xué)等團(tuán)隊(duì)在頂刊Science發(fā)表論文“Epithelial tension controls intestinal cell extrusion”,利用活體組織及能夠捕捉原代組織結(jié)構(gòu)與分子特征的小鼠腸道類器官,結(jié)合光遺傳學(xué)、激光消融和長時間活細(xì)胞成像,提出了一個全新的解釋:細(xì)胞擠出的根本驅(qū)動力并非來自于密度過高導(dǎo)致的擁擠,而是細(xì)胞之間的機(jī)械拉鋸戰(zhàn)。這種貫穿基底面的肌球蛋白II收縮網(wǎng)絡(luò)帶來的組織張力像持續(xù)的拔河,把難以承載拉力的那枚“弱環(huán)”優(yōu)先推離上皮層。該工作提出的張力模型不僅為腸道擠出的時空規(guī)律給出了力學(xué)框架,也為精準(zhǔn)干預(yù)腸道屏障相關(guān)疾病提供了可操作的工具與思路。
01 從“擁擠模型”到“拉鋸模型”
以往的假說認(rèn)為:絨毛頂端因局部密度過高,細(xì)胞被“擠”得無處可去,只能被動外排。本文中,研究者首先通過補(bǔ)充Noggin、R-spindin 1、EGF、Wnt等細(xì)胞因子,生成了小鼠腸道類器官并進(jìn)行了長時程活細(xì)胞成像,通過用 H2B 熒光標(biāo)記細(xì)胞核并自動跟蹤,幾天內(nèi)統(tǒng)計(jì)了大量擠出事件。
結(jié)果發(fā)現(xiàn),細(xì)胞擠出并不偏好密度最高的區(qū)域,反而常常出現(xiàn)在平均或偏低密度處。于是研究團(tuán)隊(duì)提出一個新假設(shè):決定細(xì)胞去留的關(guān)鍵不是“擁擠-壓縮”模型,而是張力模型。
進(jìn)一步的單細(xì)胞追蹤表明,擠出事件與局部的收縮力動態(tài)密切相關(guān)。在絨毛樣區(qū)域,基底面上肌球蛋白II的活性高度富集,形成了一個動態(tài)的收縮網(wǎng)絡(luò),進(jìn)一步證明了張力的存在。
而在野生型(WT)小鼠小腸激光消融實(shí)驗(yàn)中,一旦切斷局部結(jié)構(gòu),組織立即外向回縮,證明絨毛上皮處于被拉緊而非被壓縮的狀態(tài)。換句話說,絨毛頂端的細(xì)胞更像是被這張張力網(wǎng)“拉”出去,而不是因?yàn)閾頂D被“擠”出去。
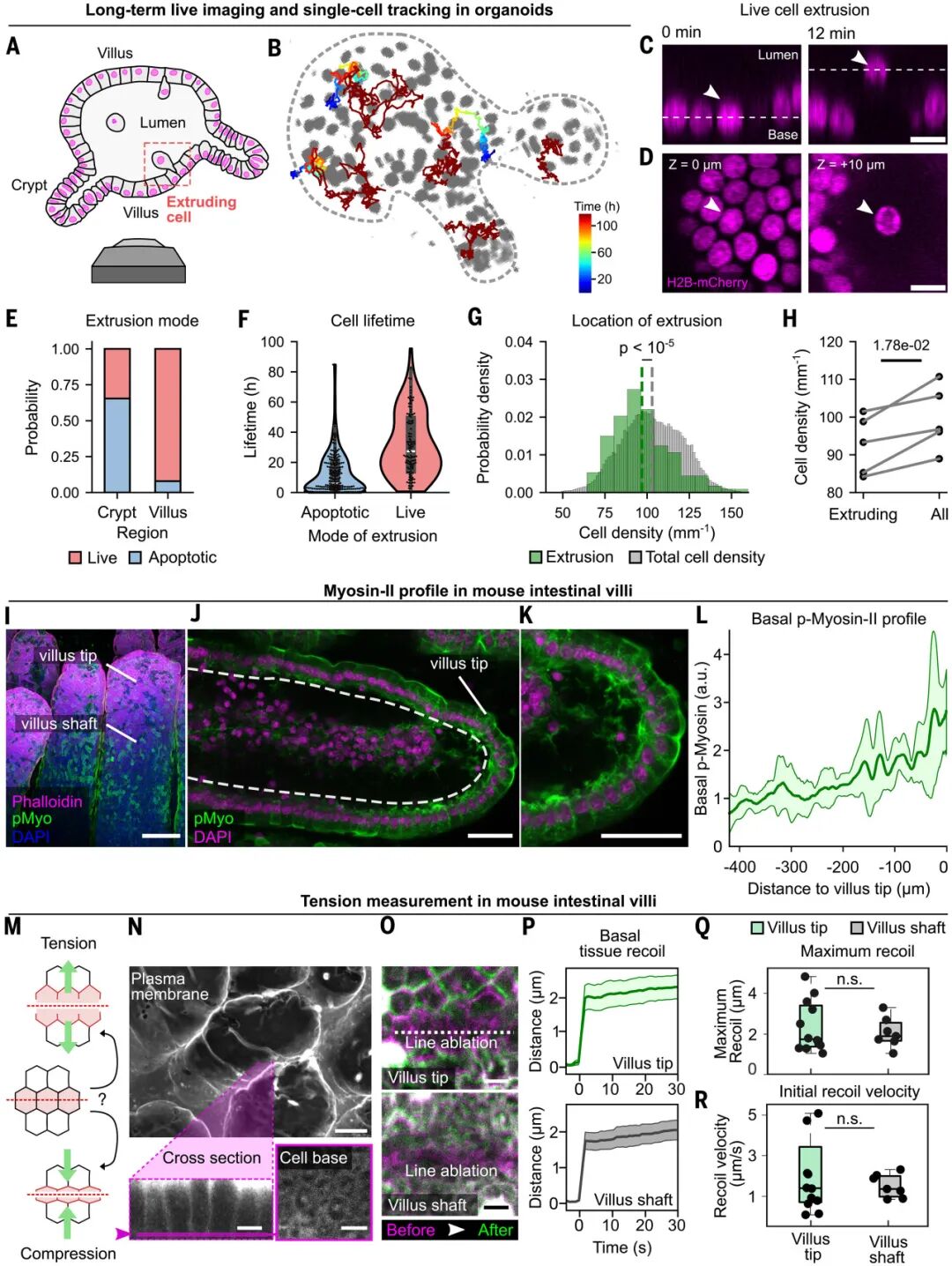
圖:腸道活細(xì)胞擠出主要發(fā)生在受張力的區(qū)域,提示擁擠密度模型不適用
02 起底張力的來源:高度動態(tài)的基底皮質(zhì)肌球蛋白網(wǎng)絡(luò)
進(jìn)一步的實(shí)驗(yàn)揭示了這一張力的分子基礎(chǔ)。在腸道類器官的基底面,研究者通過超分辨顯微鏡觀察到肌球蛋白II不僅分布在細(xì)胞邊界的連接帶,還在細(xì)胞中央?yún)R聚成放射狀結(jié)構(gòu),構(gòu)成了一個跨細(xì)胞的互聯(lián)網(wǎng)絡(luò)。這一網(wǎng)絡(luò)并非靜態(tài),而是以脈沖式的方式不斷收縮與放松。
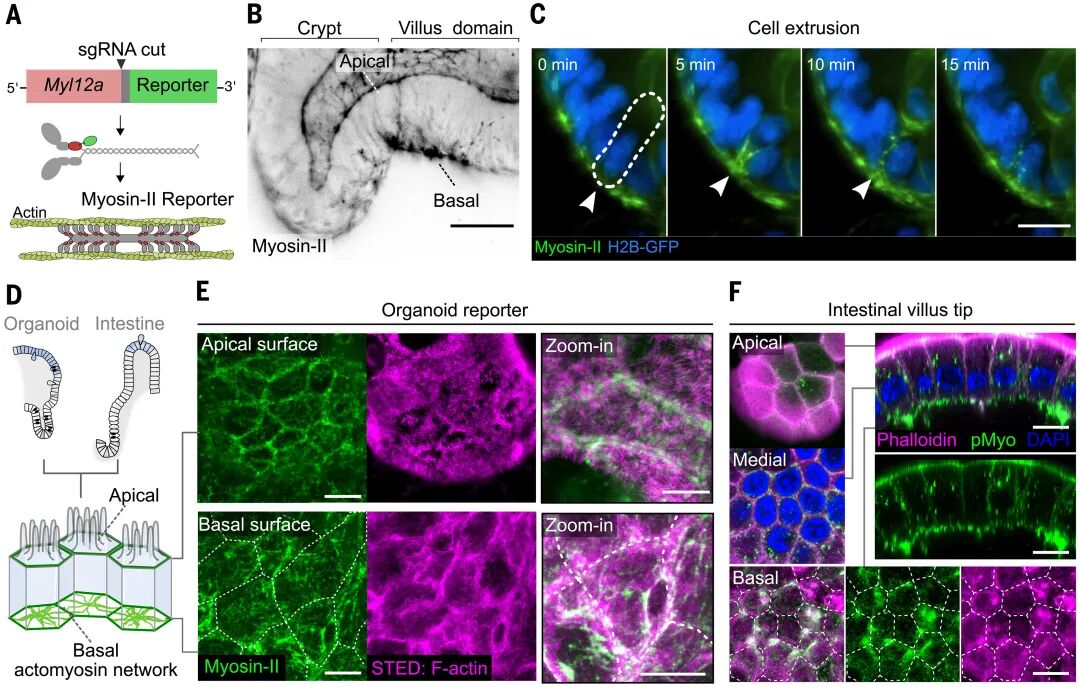
圖:基底肌動球蛋白網(wǎng)絡(luò)連接腸上皮細(xì)胞
具體而言,研究在類器官中通過CRISPR給肌球蛋白II的內(nèi)源位點(diǎn)敲入熒光標(biāo)簽,同時配合超分辨和三維成像,比對頂端與基底兩側(cè)的網(wǎng)絡(luò)結(jié)構(gòu)與動態(tài),發(fā)現(xiàn)當(dāng)某個細(xì)胞收縮時,鄰近細(xì)胞會被迫擴(kuò)張;而當(dāng)它放松時,周圍細(xì)胞則會回縮。這種動態(tài)的互作就像一場持久的“拔河”,使得整個組織保持在持續(xù)的張力狀態(tài)中。
由此,類器官為研究提供了窗口,直接可視化了絨毛區(qū)域細(xì)胞的力學(xué)博弈,并證明絨毛樣上皮底盤由會跳動的收縮單元拼成,具備隨時向外輸出張力的能力。
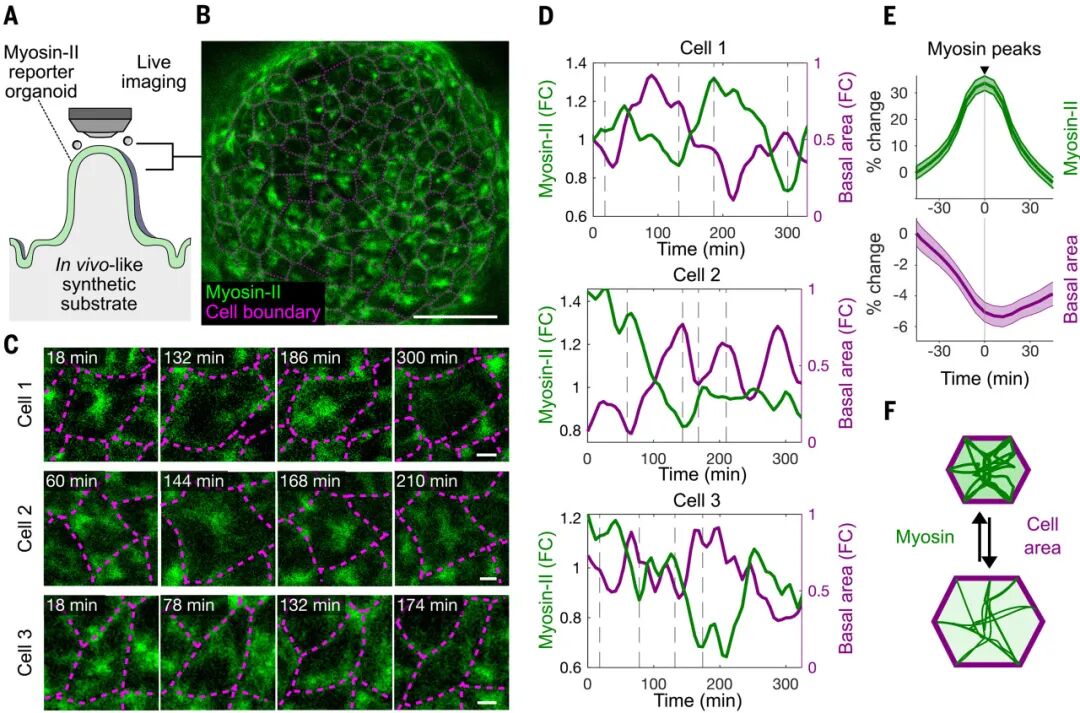
圖:腸上皮細(xì)胞利用其基底細(xì)胞骨架對鄰近細(xì)胞施加高度動態(tài)的拉力
值得注意的是,破壞基底皮層完整性及細(xì)胞骨架導(dǎo)致的張力喪失會直接導(dǎo)致細(xì)胞的擠出。該結(jié)果進(jìn)一步證明了基底面肌球蛋白II網(wǎng)絡(luò)的張力直接調(diào)控?cái)D出事件。
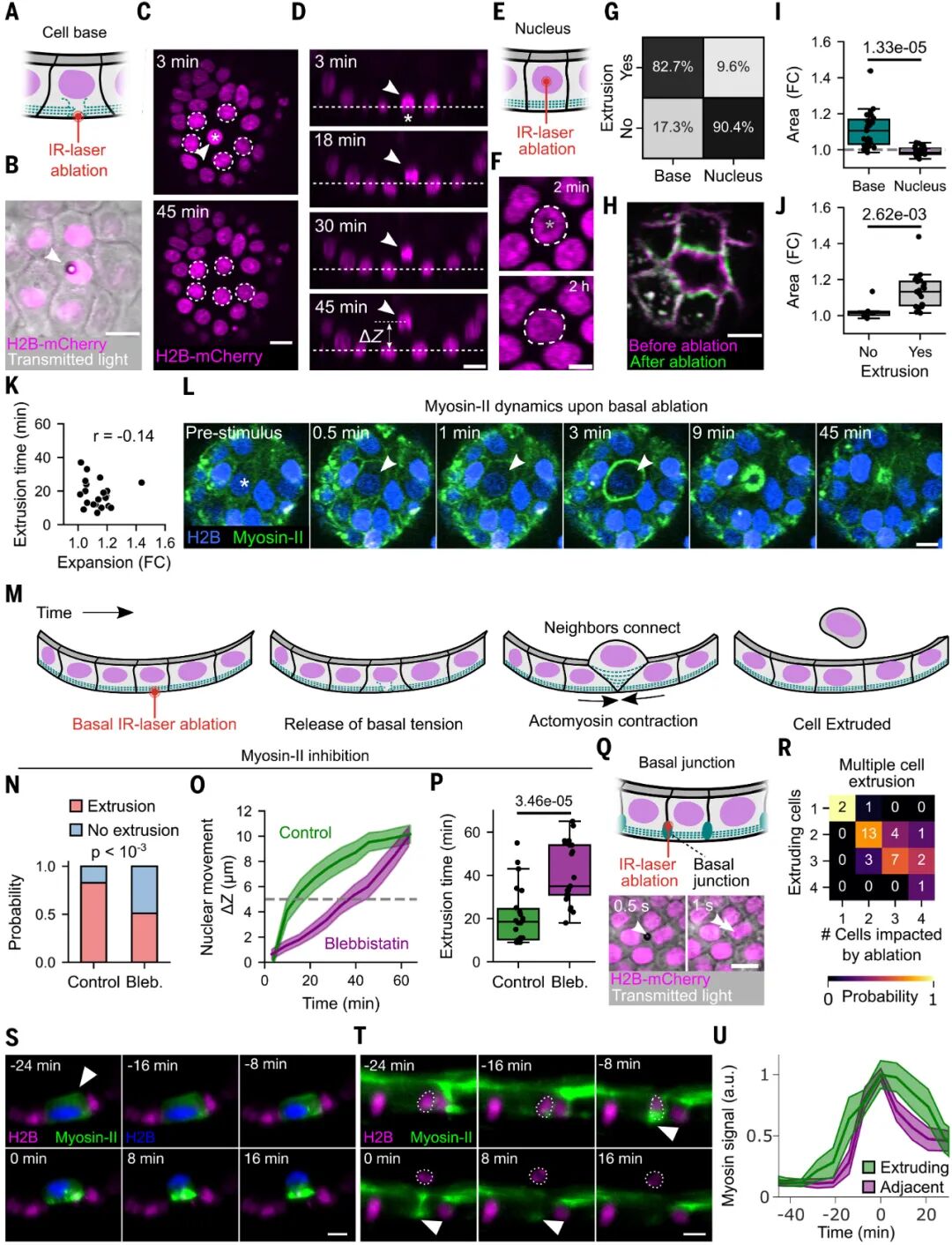
圖:組織張力的釋放引發(fā)細(xì)胞擠壓
03 誰會被淘汰?弱者出局的力學(xué)邏輯
如果張力是關(guān)鍵,那么哪些細(xì)胞更容易被擠出?團(tuán)隊(duì)利用光遺傳學(xué)手段精確操控單細(xì)胞的肌球蛋白II活性,結(jié)果顯示:當(dāng)某些細(xì)胞被增強(qiáng)收縮能力時,鄰近的正常細(xì)胞更容易被擠出;反之,當(dāng)細(xì)胞因遺傳操作或激光破壞而失去張力生成能力時,它們自己會迅速被排除。
這揭示了一個清晰的邏輯:誰的張力弱,誰就會被踢出局。馬賽克類器官實(shí)驗(yàn)進(jìn)一步印證了這一點(diǎn)——在由強(qiáng)收縮細(xì)胞和弱收縮細(xì)胞混合的類器官中,弱者被擠出的概率顯著升高。這種競爭性擠出機(jī)制,確保了組織能夠不斷清除最脆弱的環(huán)節(jié),從而維護(hù)屏障的完整。
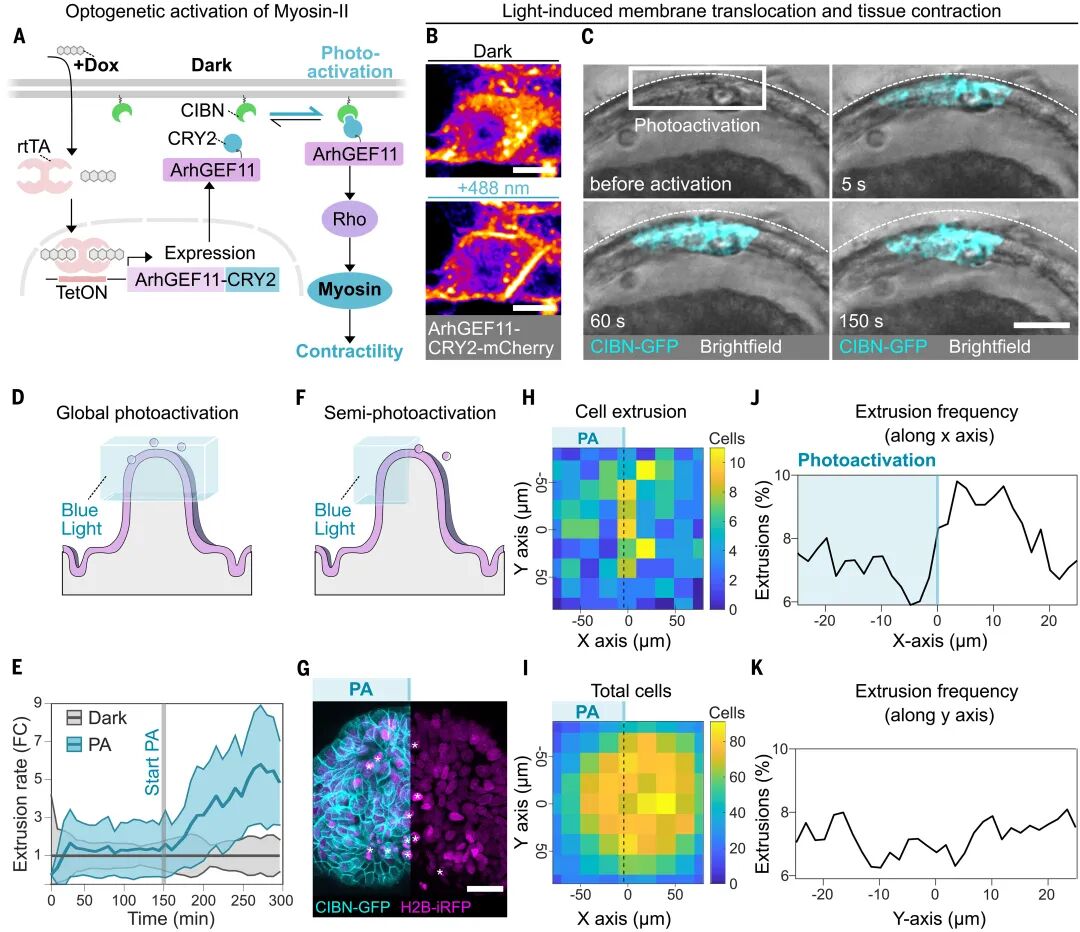
圖:細(xì)胞間張力的差異影響絨毛尖端的細(xì)胞擠出
04 先天性簇絨腸病的力學(xué)根源
這一發(fā)現(xiàn)不僅是基礎(chǔ)生物學(xué)的突破,還為臨床疑難病提供了新視角。先天性簇絨腸病(CTE)是一種罕見的嬰幼兒疾病,由上皮細(xì)胞粘附分子(EpCAM)基因缺陷導(dǎo)致,患者表現(xiàn)為嚴(yán)重腹瀉和營養(yǎng)吸收障礙。研究團(tuán)隊(duì)在CRISPR敲除EpCAM的類器官中發(fā)現(xiàn),細(xì)胞表現(xiàn)出異常的肌球蛋白II過度活化,組織結(jié)構(gòu)紊亂,擠出率顯著升高。
更關(guān)鍵的是,在EpCAM缺陷與正常細(xì)胞混合的馬賽克類器官中,正常細(xì)胞反而被優(yōu)先擠出,而缺陷細(xì)胞得以殘留。這意味著異常的張力分布打破了原有的力學(xué)平衡,使得“健康細(xì)胞”成了競爭中的輸家。這一結(jié)果為CTE的病理機(jī)制提供了直觀解釋:疾病的根源不僅是分子缺陷,更是力學(xué)網(wǎng)絡(luò)的紊亂。
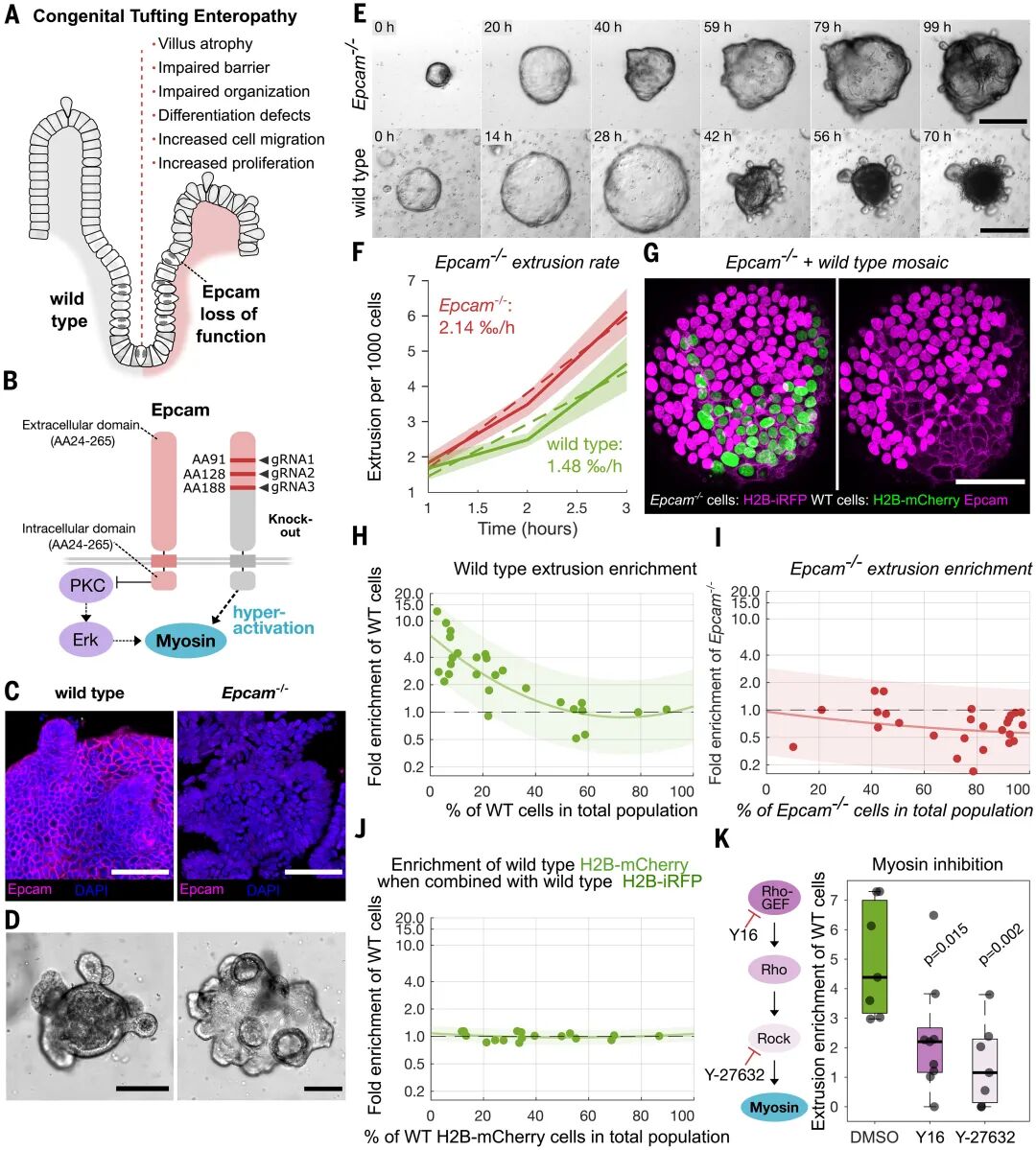
圖:CTE中EpCAM缺失導(dǎo)致肌球蛋白II過度活化,破壞上皮穩(wěn)態(tài)并導(dǎo)致競爭性細(xì)胞擠出
05 總結(jié)
本研究揭示了腸道細(xì)胞外排的力學(xué)調(diào)控機(jī)制,提出了一個基于張力的細(xì)胞外排模型。在這個模型中,動態(tài)的肌動球蛋白網(wǎng)絡(luò)產(chǎn)生組織水平上的張力,無法產(chǎn)生足夠力來抵抗鄰近細(xì)胞拉力的細(xì)胞會被優(yōu)先移除。這種“拔河比賽”機(jī)制通過消除組織中最弱的細(xì)胞來維持機(jī)械完整性。這一發(fā)現(xiàn)為理解腸道如何維持穩(wěn)態(tài)提供了新的視角,為開發(fā)新的疾病治療方法提供了潛在的靶點(diǎn)。
類器官在本研究里承擔(dān)了“可控、可復(fù)現(xiàn)、可因果”的核心角色:它在三維環(huán)境中重建了隱窩—絨毛軸,既能長時程追蹤細(xì)胞命運(yùn),又能疊加內(nèi)源肌球蛋白示蹤、光遺傳收縮開關(guān)(opto-Arhgef11)、激光微手術(shù)和仿生水凝膠等模塊,構(gòu)成從“觀測張力”到“操縱張力”、從“單細(xì)胞”到“超細(xì)胞網(wǎng)絡(luò)”、從“個體事件”到“群體競爭(嵌合類器官、擠出富集)”的一整套閉環(huán)工具箱。
近岸蛋白相關(guān)產(chǎn)品
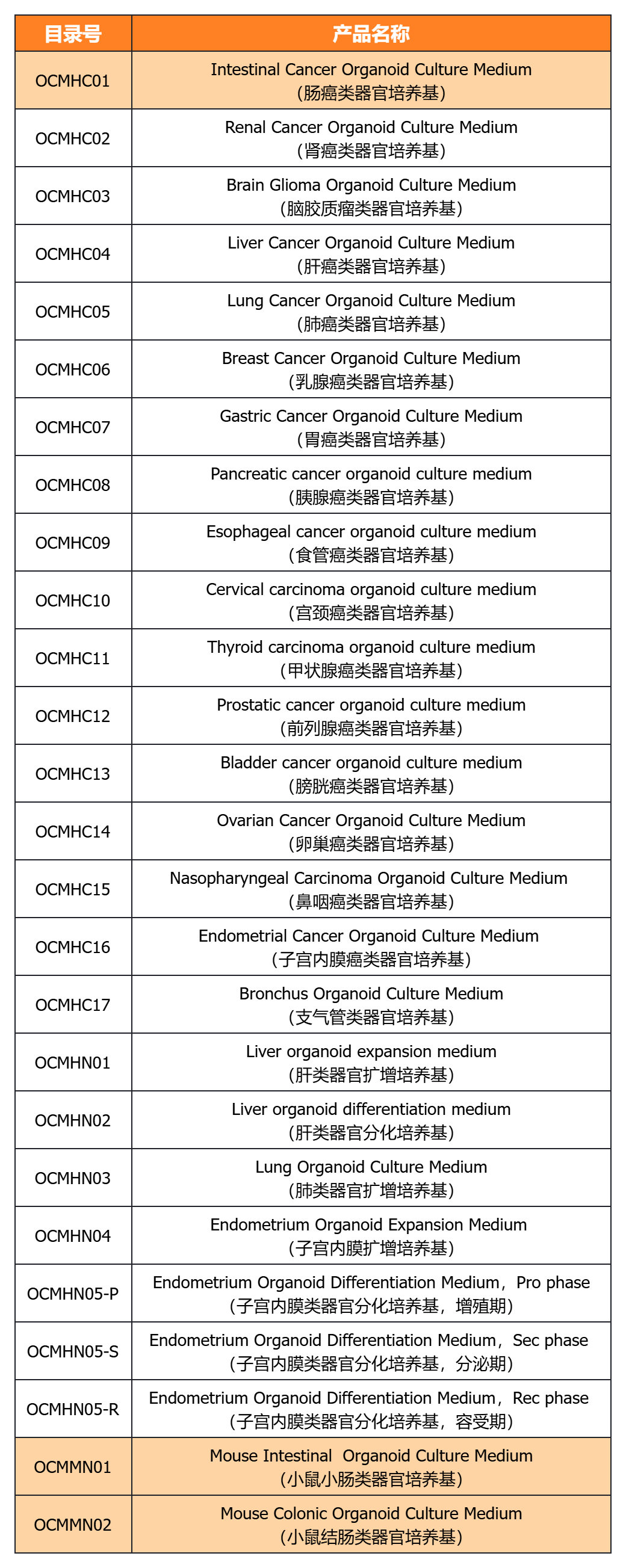
近岸蛋白提供多種類器官體外培養(yǎng)全方案,包括基質(zhì)膠、培養(yǎng)基、相關(guān)細(xì)胞因子等:
經(jīng)類器官培養(yǎng)驗(yàn)證的完全培養(yǎng)基
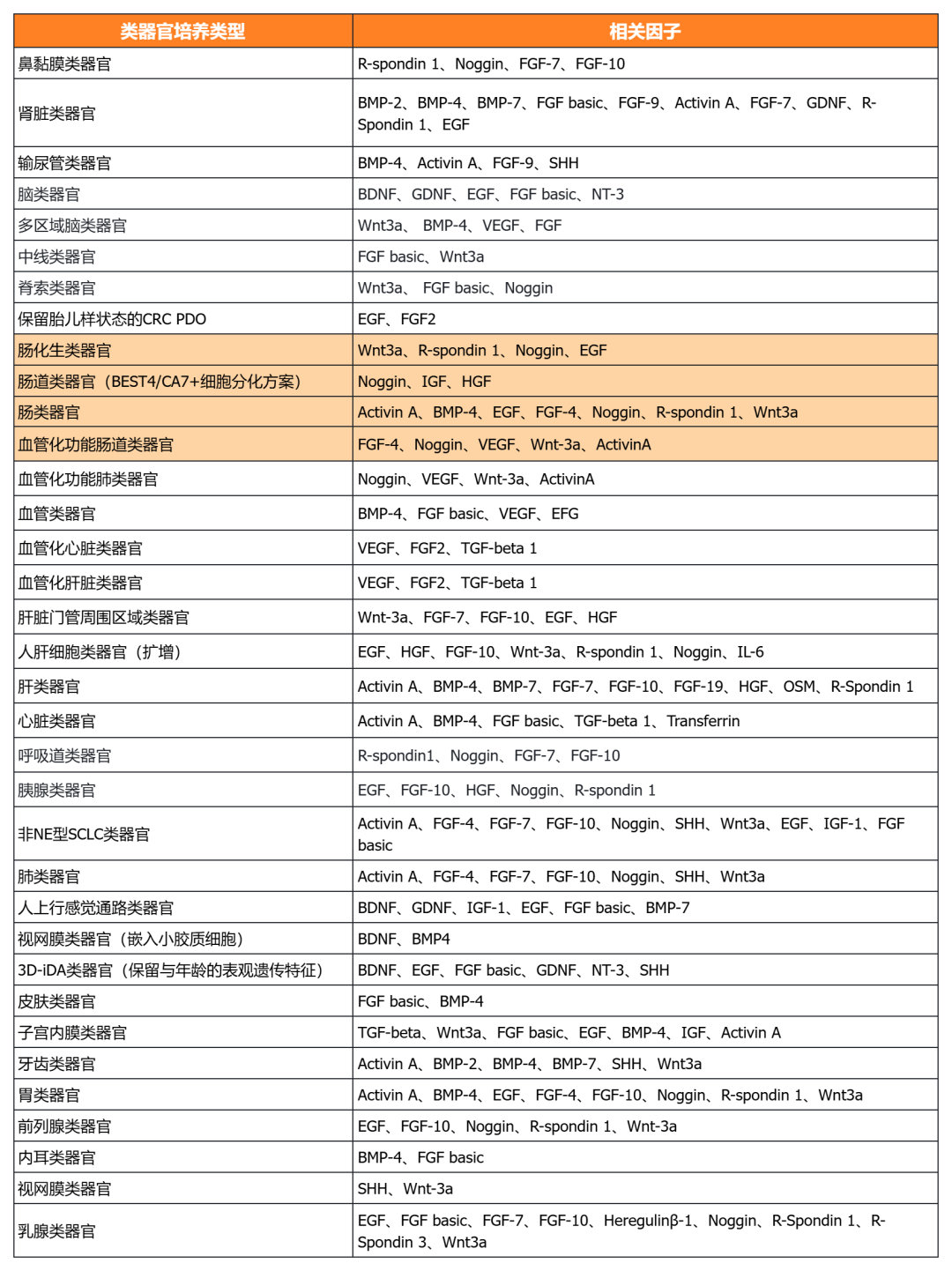
經(jīng)類器官培養(yǎng)驗(yàn)證的細(xì)胞因子
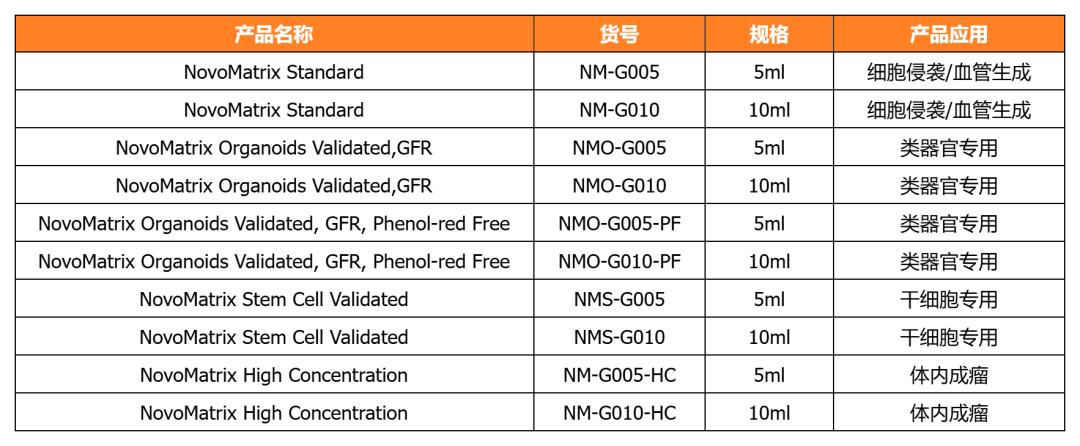
NovoMatrix 基質(zhì)膠
參考資料
Krueger D, Spoelstra WK, Mastebroek DJ, et al. Epithelial tension controls intestinal cell extrusion. Science. 2025;389(6764):eadr8753. doi:10.1126/science.adr8753
