前言
在細胞命運的體系中,分化(differentiation)是維系生命秩序的關鍵。正常上皮細胞遵循特定信號完成成熟分化,而當這一程序受阻、細胞停留在“未成熟”狀態時,便會脫離組織控制,演變為腫瘤。
在結直腸癌(CRC)中,這一失衡尤為顯著。腸道上皮依賴干細胞不斷更新,當部分細胞喪失分化能力、長期保持干性(stemness)時,就形成了具有自我更新和多向分化潛能的癌癥干細胞(CSCs)。這些細胞是CRC復發、耐藥與轉移的核心根源。傳統化療或放療雖能暫時清除增殖細胞,卻無法根除CSC群體,因此患者常出現復發。
與傳統放化療不同,分化療法旨在通過誘導腫瘤細胞重新進入分化軌跡,使其恢復成熟狀態、失去無限增殖能力,一直被視為一種極具潛力的策略,尤其是對于結直腸癌(CRC)而言。但這種策略迄今幾乎只在血液腫瘤(如急性早幼粒細胞白血病)中成功實現,在實體瘤中長期受限。主要原因在于實體瘤異質性高、分化調控網絡復雜且缺乏精確的實驗模型。
2025年10月20日,加州大學圣地亞哥分校(UCSD)研究團隊在期刊Cell Reports Medicine發表論文“CANDiT: A machine learning framework for differentiation therapy in colorectal cancer”,創新性地提出一種結合人工智能與類器官技術的系統性分化療法策略。該研究利用機器學習框架 CANDiT(Cancer-Associated Nodes for Differentiation Targeting),在結直腸癌類器官模型中突破性地找到了一個讓腫瘤細胞重新分化、并最終自毀的分子開關。激活這個名為PRKAB1的基因后,他們重新喚醒了腸道分化的主調因子 CDX2,從而成功讓腫瘤細胞恢復極化、失去干性,并最終走向凋亡。由于該療法靶向針對腫瘤細胞,而不會影響周圍組織,因此可能成為一種比現有治療方法更安全、更精準的替代方案,有望在未來根治結腸癌。
更為重要的是,研究人員介紹道,該結果不只限于CRC領域:“CANDiT 是一個端到端的人類路線圖——我們可以將它應用于任何腫瘤,找到正確的靶點,最終瞄準那些一直以來最難定義、追蹤或治療的腫瘤干細胞。通過將小規模類器官研究與臨床中大規模的人類多樣性數據相結合,我們可以構建嚴謹、可重復且可擴展的研究發現,同時又不會忽視人類疾病的本質。這種方法改變臨床醫學的潛力不僅巨大,而且不可阻擋。”
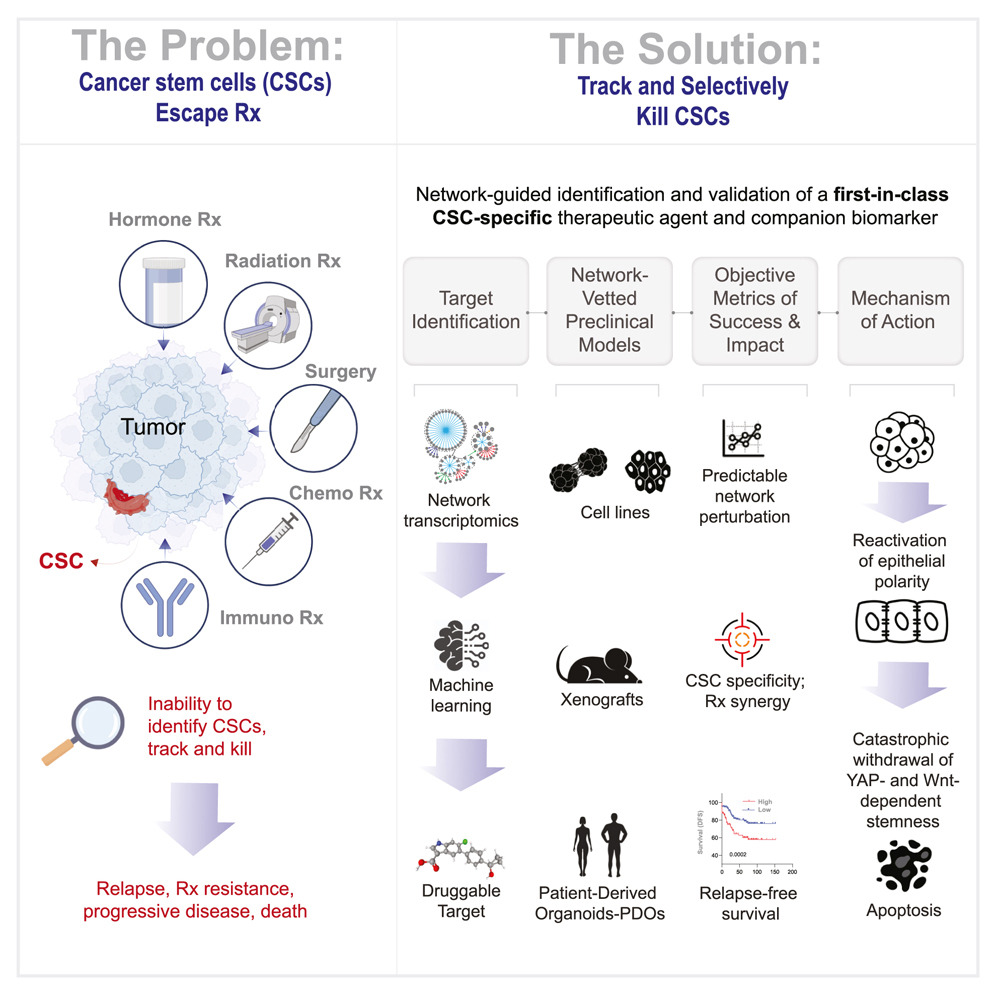
01 從基因網絡中尋找“重生鍵”
“癌癥干細胞就像浴室里的肥皂——你剛要抓住它,它又滑走。” 研究負責人、細胞網絡醫學研究所(iNetMed)教授 Pradipta Ghosh 如此形容。CSC 之所以難纏,是因為它們掌握了改變身份的能力:當周圍環境受威脅時,它們能“偽裝”成普通腸上皮細胞,避開治療攻擊,等藥物退去再度恢復干性。
這場“追蹤與逃逸”的戰爭幾乎貫穿所有癌種。團隊意識到,如果不能摧毀這種多態性,就無法真正治愈癌癥。于是他們轉向了機器學習——讓算法幫人類識別出細胞命運的弱點。
研究團隊以布爾推論網絡(Boolean implication-based transcriptomic modeling)為理論基礎,構建了一個可解析細胞分化軌跡的機器學習平臺CANDiT 。CANDiT 的核心目標不是尋找傳統意義上能夠殺死腫瘤細胞的“致死靶點”,而是通過反向推理,識別可恢復分化程式的“調控中樞”。
在結腸癌中,CDX2的缺失被視為腫瘤去分化的標志。CDX2表達缺陷型腫瘤(CDX2-low)具有更高的干性與更差的生存預后。研究者因此以腸上皮分化主調控因子CDX2為起點,在1662例結直腸癌樣本、68 個腺瘤和170個正常組織的轉錄組中訓練模型,試圖找出那些與CDX2存在穩定、單向邏輯關系的上游節點。最終,通過網絡推理,研究團隊鎖定了五個潛在上游調控節點,其中PRKAB1(AMPK復合物β1亞基)脫穎而出——它不僅在腸道上皮中高表達,還具有可藥物靶向的結構。
PRKAB1編碼一種能量感應與細胞極性調節蛋白,長期以來被認為在腸道穩態中發揮核心作用,負責幫助細胞在能量緊張時維持極性與平衡。其在多數結直腸癌中卻被沉默。研究者在蛋白質數據庫中檢索到一款可直接激活PRKAB1的臨床級小分子PF-06409577(PF,一種在I期臨床中驗證安全的AMPK β1特異性激動劑)。CANDiT預測表明,在CSC中激活PRKAB1后,奇跡出現了:
CDX2表達恢復,分化通路復蘇,細胞極性恢復,YAP與Wnt信號被壓制。最令人震驚的,是那些重新“變好”的細胞最終選擇了自毀。第一作者Saptarshi Sinha形容道:“仿佛它們意識到自己失去了腫瘤的身份,無法再存活。”
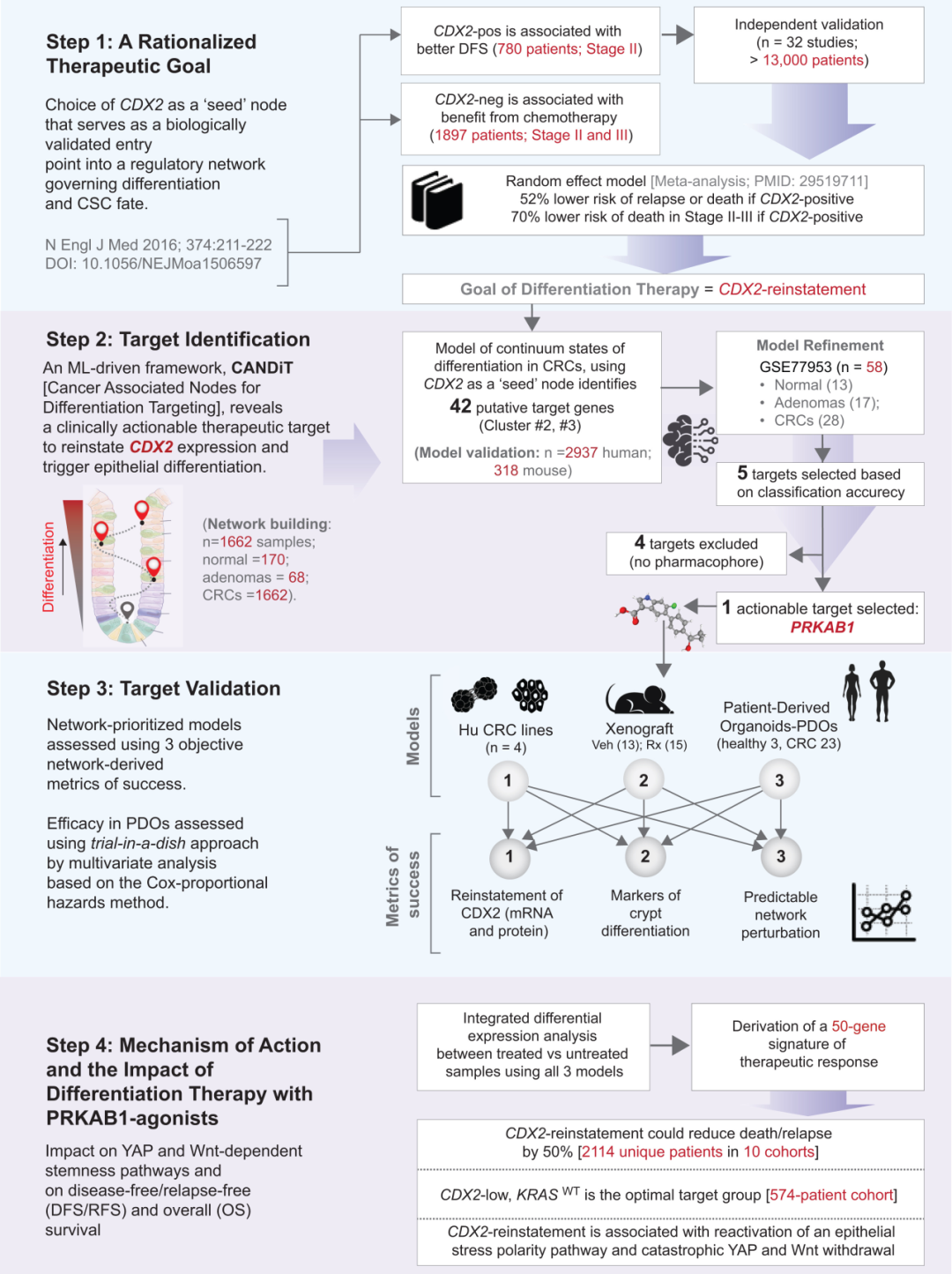
圖:研究設計
02 類器官體系驗證:分化療法的精準模型
為了在近似人體生理環境中驗證算法推斷,研究團隊依托UCSD HUMANOID™類器官中心進行了驗證。類器官是由患者腫瘤細胞在三維培養體系中自組裝形成的“微縮人類組織”,其保留了腫瘤的基因突變譜、極性結構與藥物響應特征,是連接實驗室發現與臨床應用的關鍵橋梁。而患者來源類器官(PDOs)保留了獨屬于患者的個性化特征,具有相對更高的體外模擬保真度。
實驗中,研究者把PF-06409577應用于多組患者來源類器官(PDOs)。結果顯示,在CDX2低表達的PDOs中,PF促使腫瘤腺體重新極化、黏附連接恢復,展現出強效的抗腫瘤活性。轉錄組測序進一步顯示,PF誘導了腸隱窩頂端分化細胞的特征表達(如黏液細胞與吸收細胞標志基因),而腫瘤干性標志物(如ALDH3A1、ASCL2、YAP)顯著下降。換句話說,它讓腫瘤細胞“想起自己本來是誰”,并在恢復身份的過程中走向自我消亡。
與此同時,健康組織或CDX2高表達類器官則幾乎未受影響。也就是說,CANDiT不僅找到了一種“重編程”腫瘤的策略,還天然具備精準性——僅在干性與分化失衡的腫瘤細胞中被重新激活。
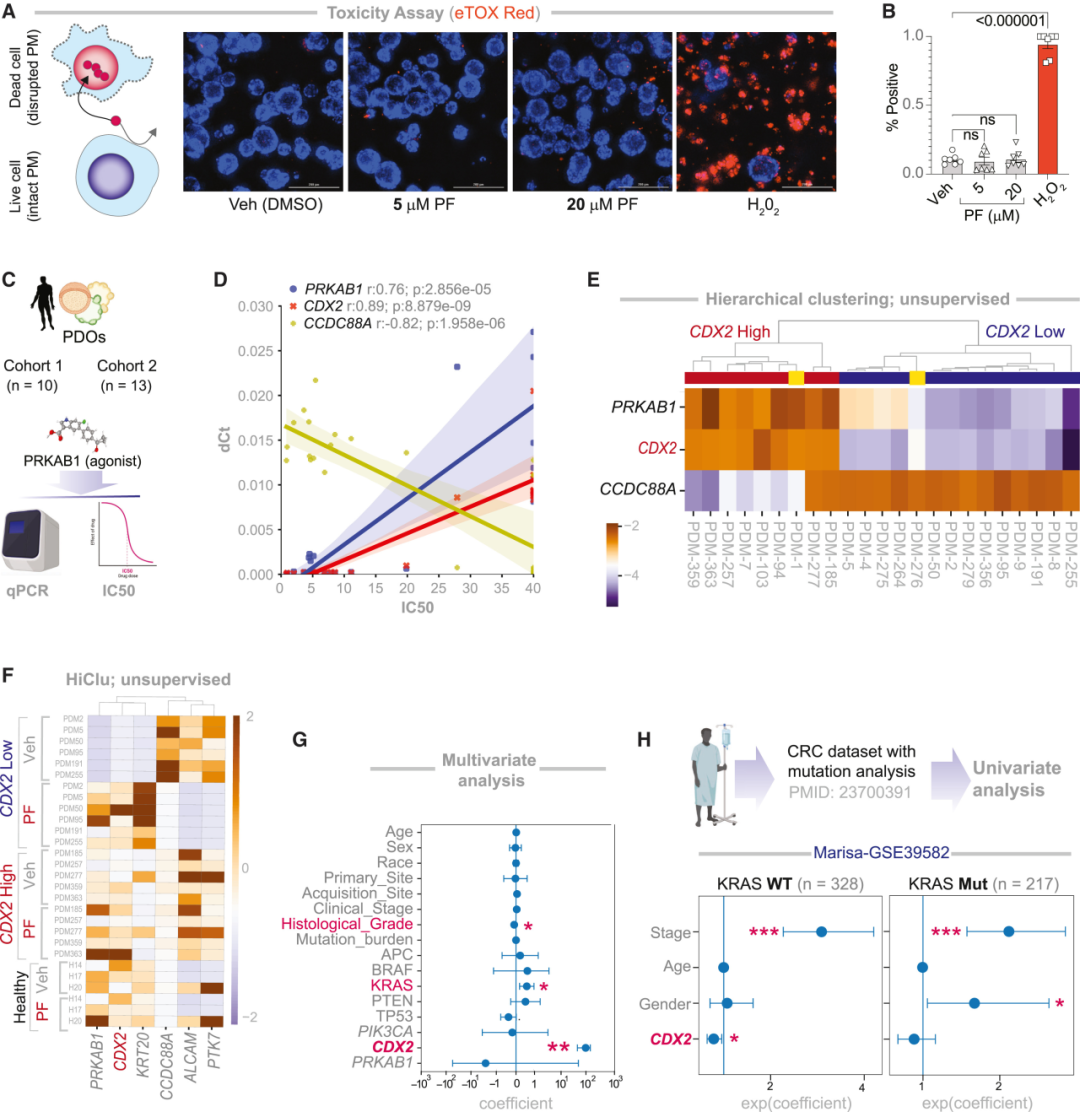
圖:PRKAB1 激動劑的分化和抗癌作用僅限于CDX2low PDOs
此外,在異種移植瘤模型中,PF處理使腫瘤體積平均減少68%,存活期延長62.5%,組織學顯示分化標志顯著恢復。該系列結果證明:通過系統性計算識別并重啟分化主控因子,可以在實體瘤中實現功能性“去干化”療法。
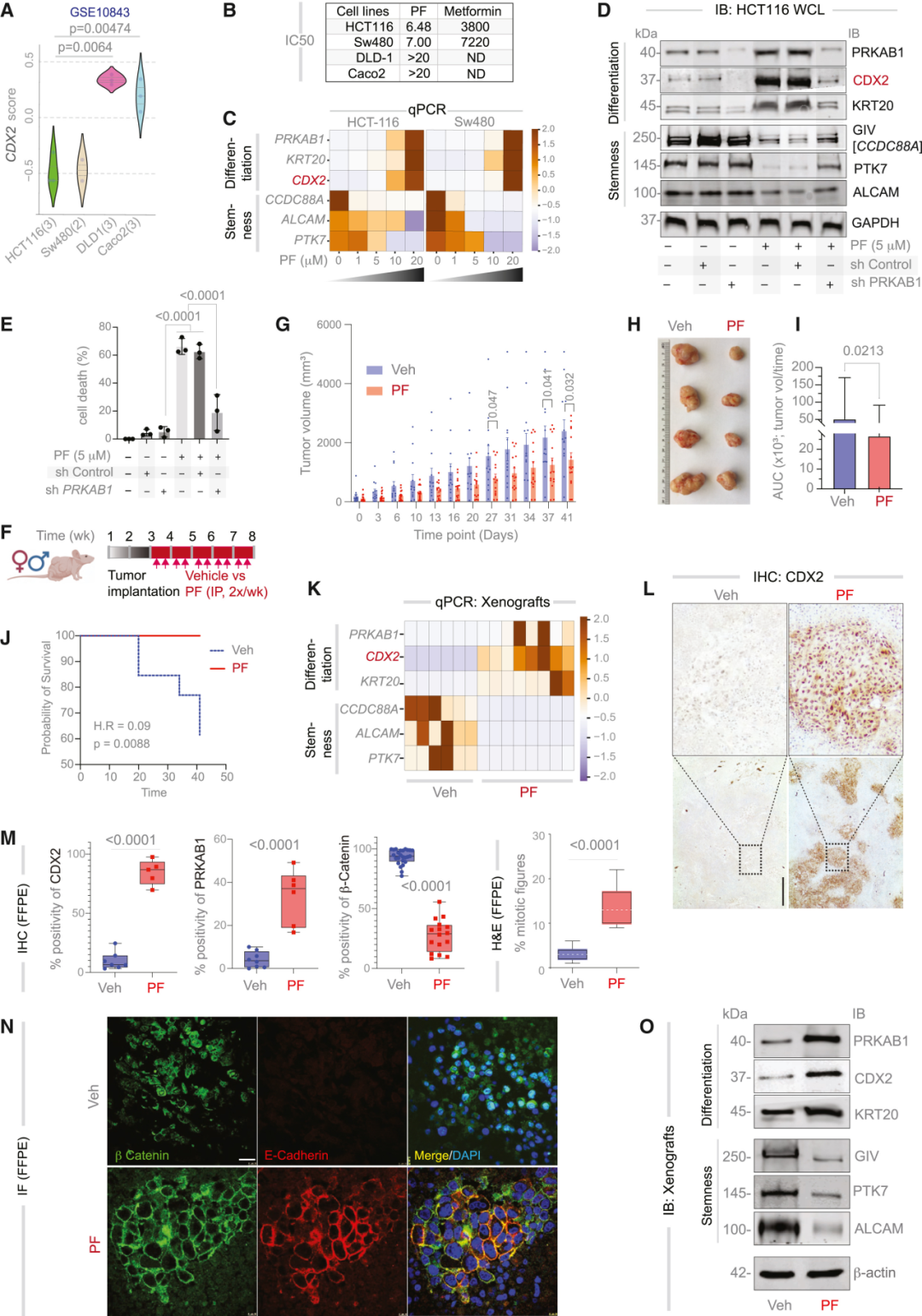
圖:CRC細胞系和異種移植模型中的靶點驗證
03 跨平臺推廣與轉化前景
CANDiT的意義在于建立了一套可擴展的邏輯框架,可適用于其他實體瘤類型。只需根據不同組織選擇相應的譜系主調控基因(例如肝癌中的HNF4A、胰腺癌中的PDX1),便能通過機器學習建立對應的分化網絡并反向追溯其上游可藥靶點,從而在類器官中驗證“重建譜系”的可行性。這一思路讓“實體瘤分化療法”第一次具備了系統性和可預測性,使腫瘤藥物發現從高通量隨機篩選轉向計算推理驅動的靶點重建,可解釋性強、成本可控,并能以真實組織體系為基礎實現跨患者驗證。
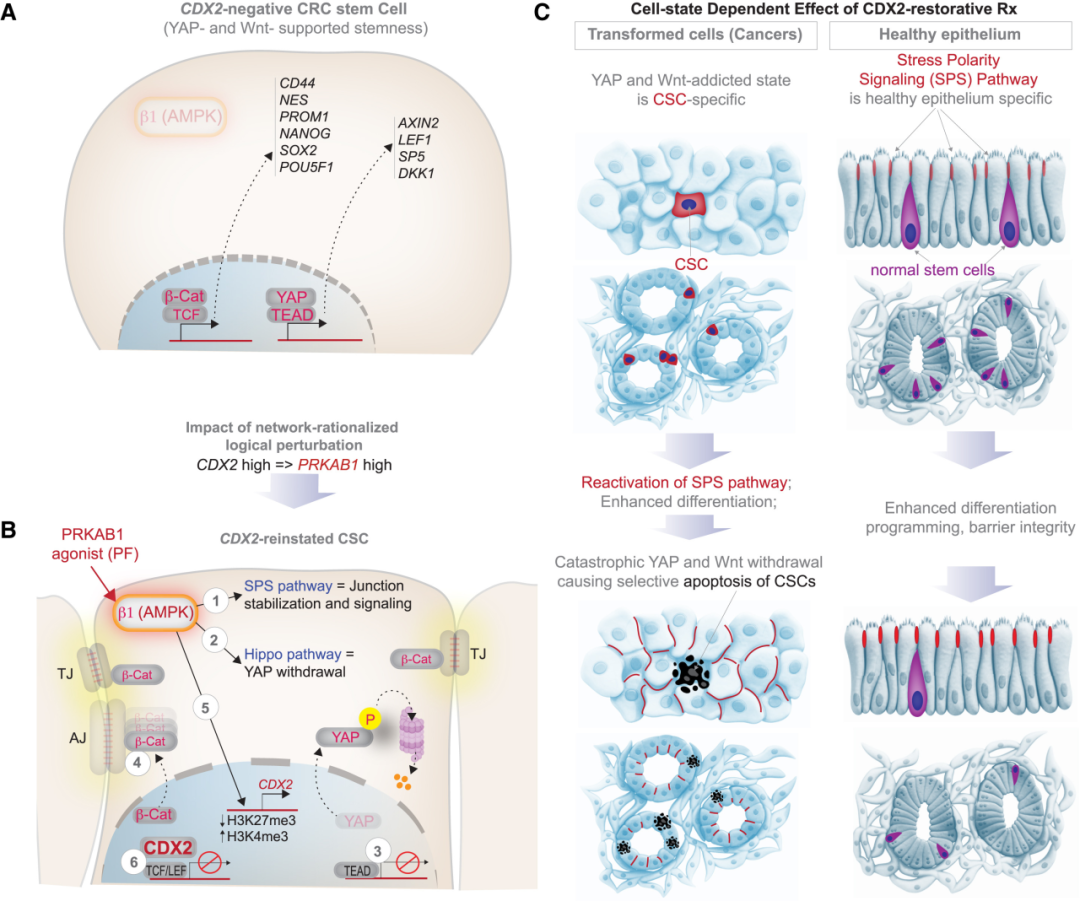
圖: CDX2 恢復如何選擇性靶向 CRC 干細胞的總結和工作模型
04 類器官引領的腫瘤治療革命
過去,動物模型常常誤導藥物篩選,因為它們無法完全重現人類代謝環境。而類器官因其在體外重建人類組織微結構、代謝網絡與信號通路的能力,已成為替代動物實驗的關鍵模型,截至2024年初,全球已有106項臨床研究直接應用類器官模型。
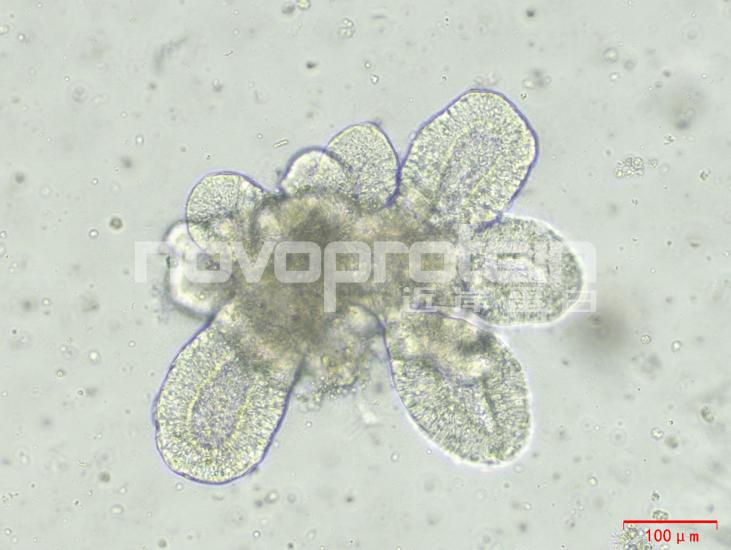
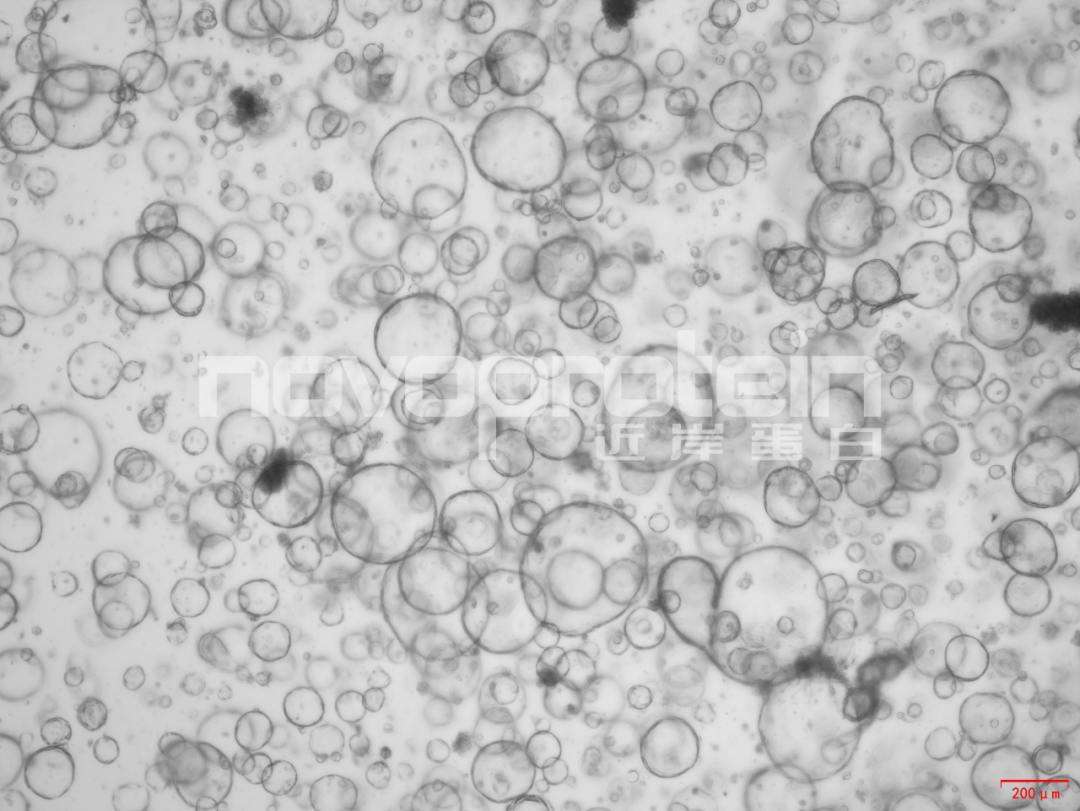
圖:經近岸蛋白細胞因子驗證培養的類器官(從左至右,從上至下:乳腺癌類器官、ipsc來源的人小腸類器官、小鼠胃類器官及小鼠膽管類器官)
在政策的扶持與技術的突破下,近年來,類器官技術已經從實驗室原型逐步走向系統化、規模化階段,正成為全球生物醫藥領域增長最快的技術板塊之一。2024 年,ATCC發布15種認證類器官細胞系,確立了國際質量基準;全球已有12家CRO機構提供GMP級篩選服務,美國和歐洲相繼啟動類器官數據監管指南與產業合作計劃,尤其美國FDA與EMA均已發布政策,逐步接納類器官數據作為臨床前評價的重要依據。根據Astute Analytica 2025年報告,2024年全球類器官與球狀體市場規模約10.7億美元,預計2033年將突破66億美元,年均復合增長率高達 22.4%。
在這一宏觀背景下,UCSD團隊的CANDiT研究正代表著類器官與人工智能結合的方向性成果:通過機器學習解析分化網絡,再以PDO體系驗證“細胞命運重編程”,真正實現了計算推理到生物驗證的閉環。這意味著,類器官正在超越其“藥篩模型”的角色,成為探索癌癥分化、重建細胞命運與實現個體化治療的核心載體。
未來,這一框架若能在臨床中驗證,將標志著分化療法從理論走向實踐。“CANDiT+類器官”的模式更是有望成為推動“可計算分化醫學”發展的核心框架,為更多實體瘤的診治帶去新的希望。
近岸蛋白相關產品
近岸蛋白依靠專業的研發團隊,精心打造類器官驗證平臺,可提供一系列經驗證、高活性、高穩定性的類器官培養產品,助您高效快速開展類器官實驗!
NovoMatrix-經類器官培養驗證的基質膠
近岸蛋白提供經類器官/干細胞培養驗證的系列NovoMatrix基質膠,產品批次穩定可控,讓您的類器官/干細胞培養更可控!
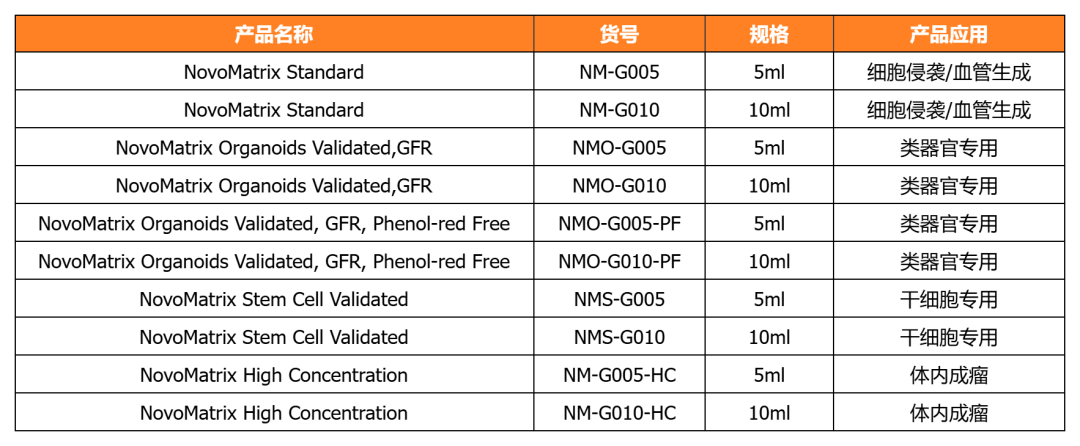
NovoMatrix支持多種類器官培養
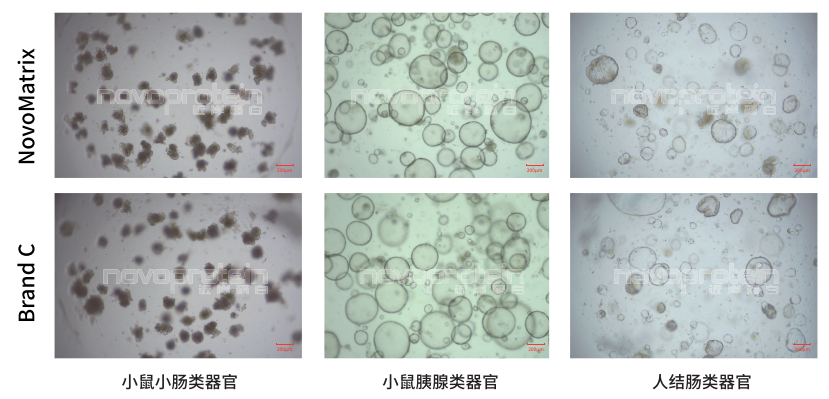
NovoMatrix Organoid Validated,GFR,Phenol Red-Free (Cat.No.:NMO-G005-PF) and a similar product of Brand C were used for culture of different organoid models
NovoMatrix支持類器官穩定傳代

NovoMatrix Organoid Validated,GFR,Phenol Red-Free (Cat.No.:NMO-G005-PF) maintain stable passage of organoids comparable to a similar product of Brand C
經類器官培養驗證的細胞因子
近岸蛋白自主研發生產并經過類器官培養驗證的低內毒素Activin A、BMP-4、EGF、FGF-7、FGF-10、FGFb、FGF8b、HGF、IGF1、Noggin、NRG1、R-Spondin 1/3和Wnt3a等細胞因子,已經在人腫瘤類器官如垂體瘤類器官、腦膜瘤類器官、乳腺癌類器官,人正常類器官如ipsc來源的人小腸類器官,以及小鼠正常類器官如小腸類器官、結腸類器官、胃類器官以及膽管類器官等體外模型上進行了驗證。
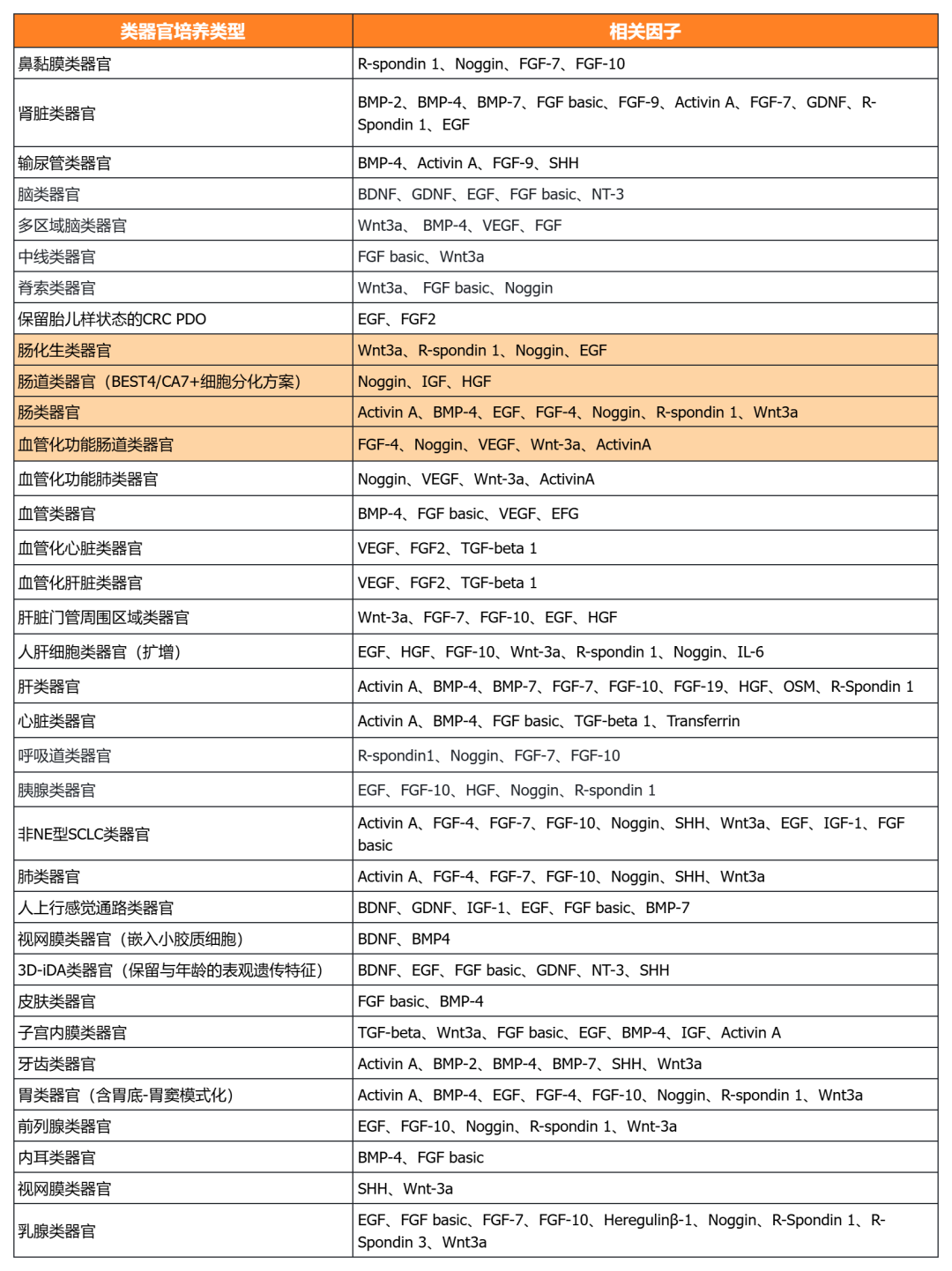
經類器官培養驗證的完全培養基
參考資料
Sinha S, Alcantara J, Perry K, et al. CANDiT: A machine learning framework for differentiation therapy in colorectal cancer. Cell Rep Med. Published online October 20, 2025. doi:10.1016/j.xcrm.2025.102421
