胰腺(pancreas)包含內分泌和外分泌腺,深度參與消化和代謝平衡(圖1)[1]。內分泌胰島(islets)分泌胰高血糖素和胰島素進入血液控制血糖。外分泌腺由胰腺導管(duct)和腺泡(acini)構成,后者儲存和分泌消化酶進入十二指腸參與蛋白質、淀粉、脂肪等的消化。
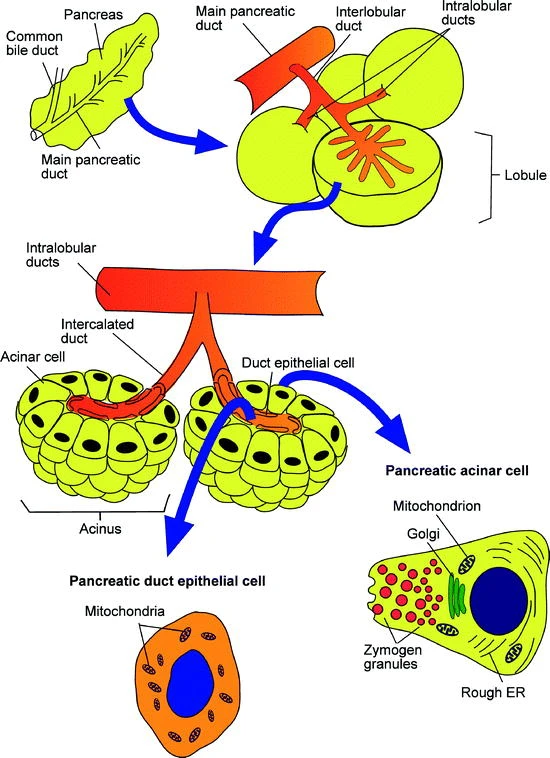
圖1:胰腺的結構
(來源:參考資料[1])
臨床和醫學研究中,如何獲得合理的胰腺模型已成為長久的困擾。采取胰腺活檢的手段易出現并發癥,臨床風險較高。手術標本來源的胰腺則受制于獨特的病理特征,丟失了正常胰腺組織的生理數據。另一方面,基于嚙齒動物等的體內模型存在培養耗時久、成本高昂等桎梏。此外,來自永生化細胞系或原代細胞的2D培養模型則缺乏細胞極性、細胞間作用、細胞與細胞外基質間作用等重要數據。
相較而言,類器官作為一種通過細胞自組織產生的3D細胞集合體,可以模擬來源組織原始的結構和功能,表征胰腺表觀遺傳、轉錄組和蛋白質組等水平的分子特性,已經逐漸成為胰腺研究重點平臺。2025年1月16日,加州大學微生物與分子遺傳學系研究團隊在期刊Experiment & molecular medicine發表綜述性論文“Advancing pancreatic cancer research and therapeutics: the transformative role of organoid technology”,對胰腺導管腺癌類器官的歷史、技術、應用等進行了全面闡述。綜合該文,Organoids總結了胰腺類器官從培養到應用的全方位參考,詳細舉例了成體組織來源、病理來源的類器官培養要點,并對當下胰腺癌類器官的困局與重點改良方向進行了探討。

(來源:參考資料[2])
01 胰腺類器官的建立
胰腺起源自內皮層前腸上皮的兩個不同區域,在發育過程中受中胚層動態信號的調控,且當胰腺祖細胞特化后,中胚層間充質細胞還會聚集成為胰腺間充質,深度參與胰腺器官發生。因此,胰腺是包含內胚層和中胚層來源細胞的多組織器官,受上皮-間充質轉化作用影響,具有高度異質性(圖2)[3]。長期以來,由于其分子發育機制復雜不明晰,從干細胞獲得胰腺類器官存在困難。
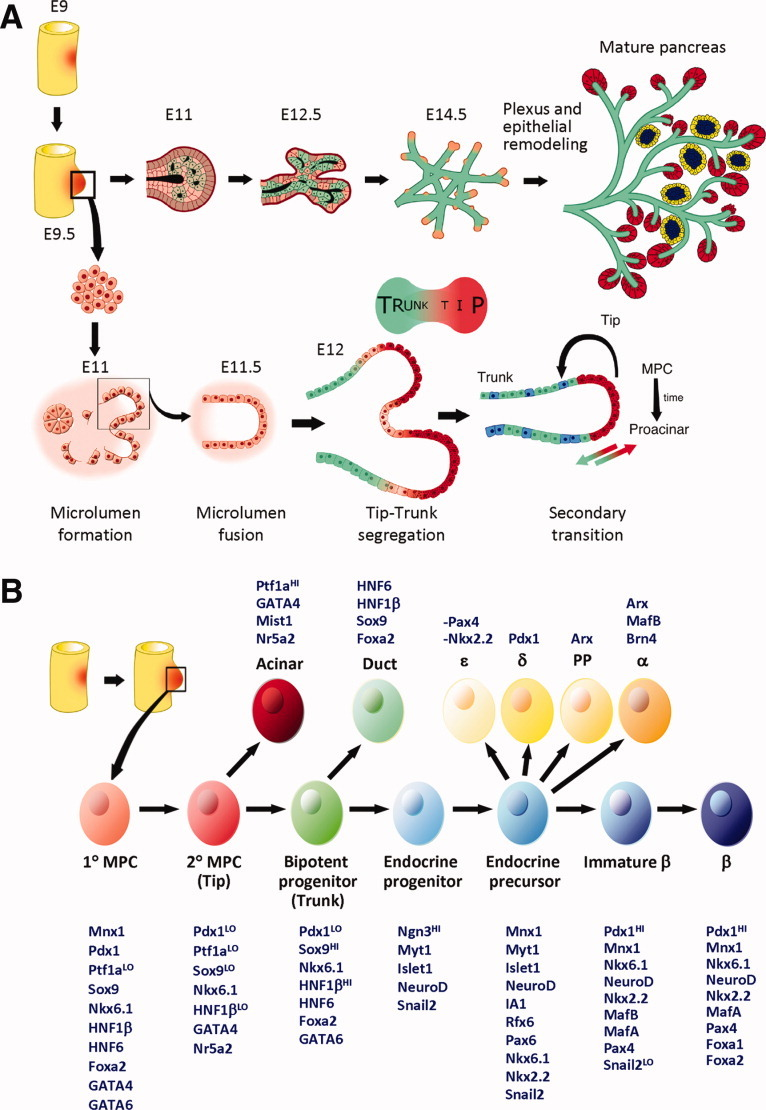
圖2:小鼠胰腺器官發生示意圖
(來源:參考文獻[3])
胎兒組織來源
2012年,瑞士洛桑聯邦理工學院團隊首次證明,胚胎小鼠胰腺祖細胞可以培養為具有三系(腺泡,導管和內分泌)分化潛力的自組織3D結構[4]。此前,少量分離的胰腺祖細胞最多只能維持存活幾天。該團隊在實驗中發現,來自間充質的成纖維細胞生長因子10(FGF10)有助于胰腺祖細胞的維持和擴增,同時還會減少腺泡分化。與此同時,FGF1也參與限制內分泌分化,而對擴增、分支或外分泌分化沒有顯著影響(圖3)[4]。
該研究表明,胰腺祖細胞的體外維持和擴增需要活性Notch和FGF信號傳導以重現體內微環境信號傳導相互作用。在培養后期,則需要從培養基中去除FGF1并抑制FGF信號傳導,以抑制間充質信號傳導,從而促進內分泌細胞的形成。
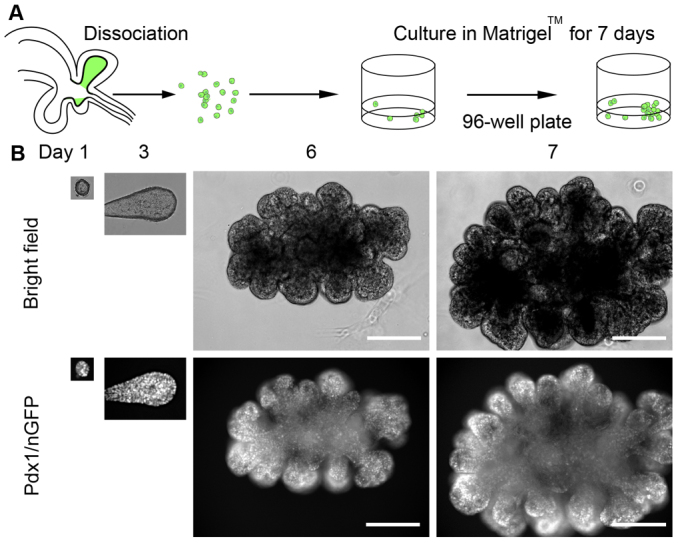
圖3:胎兒組織來源胰腺類器官的體外擴增和形態發生
(來源:參考文獻[4])
FGF / novoprotein
FGF是一類普遍存在于哺乳動物體內的促細胞分裂肝素結合蛋白,其與受體FGFR及下游的信號轉導參與了胰腺、肺、心臟、泌尿系統、腦、骨骼、肌肉、皮膚、血管以及淋巴管等幾乎所有器官的發育,此外在神經調節、代謝調節中也有重要作用。除FGF10參與胰腺類器官的生成以外,FGF家族還廣泛參與肺、胃、肝臟、心臟等多種類器官的培養。
近岸蛋白提供一系列經過多種類器官模型體外培養驗證的高活性、高批間一致性的FGF家族重組蛋白。
成人組織來源
盡管胎兒胰腺祖細胞來源的類器官已經在胰腺發育的研究中已經取得了很大進展,然其獲得難度及倫理問題還是阻礙了更為廣泛的應用。相較而言,成人組織擁有更豐富的組織干細胞來源,且成人胰腺具有部分再生能力。
再生過程中,Lgr5可作為導管的標志物。而Lgr5同時也是WNT激動劑R-spondin的輔助受體。事實上,來自成年小鼠胰腺的導管部分可在添加有R-spondin的體外培養基中啟動Lgr5表達,并繼續在補充有EGF、FGF10的條件下生成類器官。移植至腎包膜下后,該胰腺類器官可進一步誘導分化為導管和內分泌細胞(圖4)[5]。
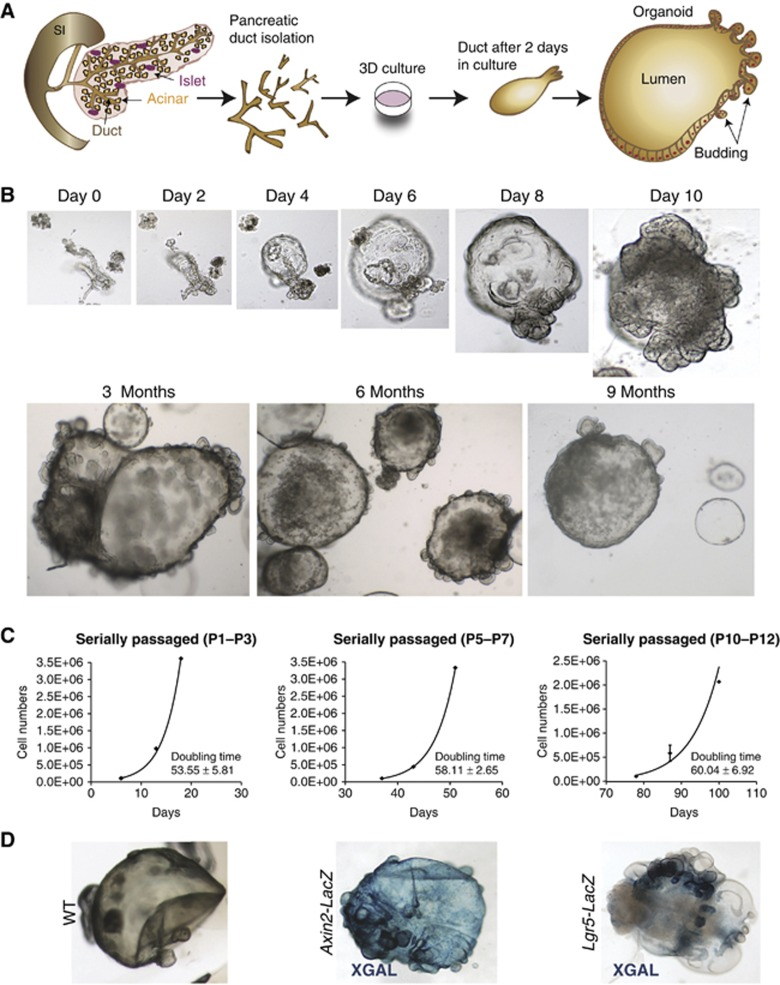
圖4:成人胰腺導管類器官的建立
(來源:參考文獻[5])
WNT刺激對于胎兒組織來源的類器官培養同樣有效。比利時和法國研究團隊通過添加WNT激動劑R-Spondin1,FGF10和EGF等細胞因子,成功使來自人類胎兒胰腺組織的胰腺祖細胞保持擴增長達5個月[6]。研究還發現,EGF信號在促進小鼠和人胚胎胰腺祖細胞的體外擴增同時抑制內分泌分化[7]。
總之,在組織來源的胰腺類器官培養中,FGF、WNT及EGF的添加對于胰腺祖細胞的擴增至關重要。
干細胞來源
2015年,加拿大多倫多大學的研究者們通過WNT、Notch、TGF-β和Hedgehog通路的調控及復雜的生長因子組合,首次從人胚胎干細胞(hESC)衍生的胰腺祖細胞獲得了具有腺泡和導管結構的胰腺上皮類器官(圖5)[8]。與前述類似,該研究發現,抑制TGF-βRI(TGF-β受體I)和Notch可促進分化成導管和腺泡,而Hedgehog抑制和WNT激活在誘導階段II和III阻礙了向胰腺譜系的分化,需要在培養過程中施加進一步的調控。
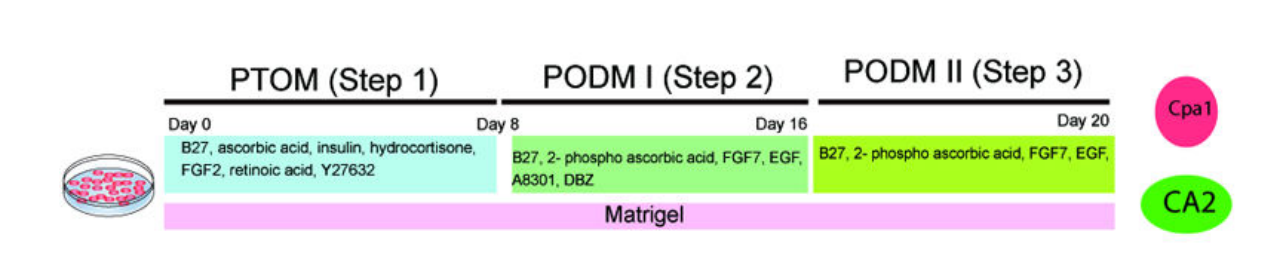
圖5:hESC來源胰腺類器官的分化方案
(來源:參考文獻[8])
不過,對于內分泌的胰島而言,WNT4會作為代謝成熟因子,在完全化學成分確定的培養基中促進功能性人類胰島樣類器官(HILO)的產生[9]。
病理來源
95%的胰腺癌發生在外分泌腺,尤其是胰腺導管腺癌(PDAC),由于診斷晚、治療效果差,已成為最致命的惡性腫瘤之一。2016年,Hans Clevers和其團隊從正常和PDAC小鼠和人胰腺組織分別建立了類器官模型(圖6)[10]。在人腫瘤組織來源的培養基中,研究團隊添加了TGF-β抑制劑A83-01,用于增殖的R-Spondin1、WNT-3a、以及胰腺再生期間的形態發生原EGF、FGF10等。而人正常胰腺類器官的培養中,研究人員則額外添加了前列腺素PGE2以進一步促進其增殖。最終獲得的類器官可在體外保持擴增、傳代,并不發生惡性轉化超過十個月。原位移植到小鼠胰腺后,這些類器官可產生導管結構。
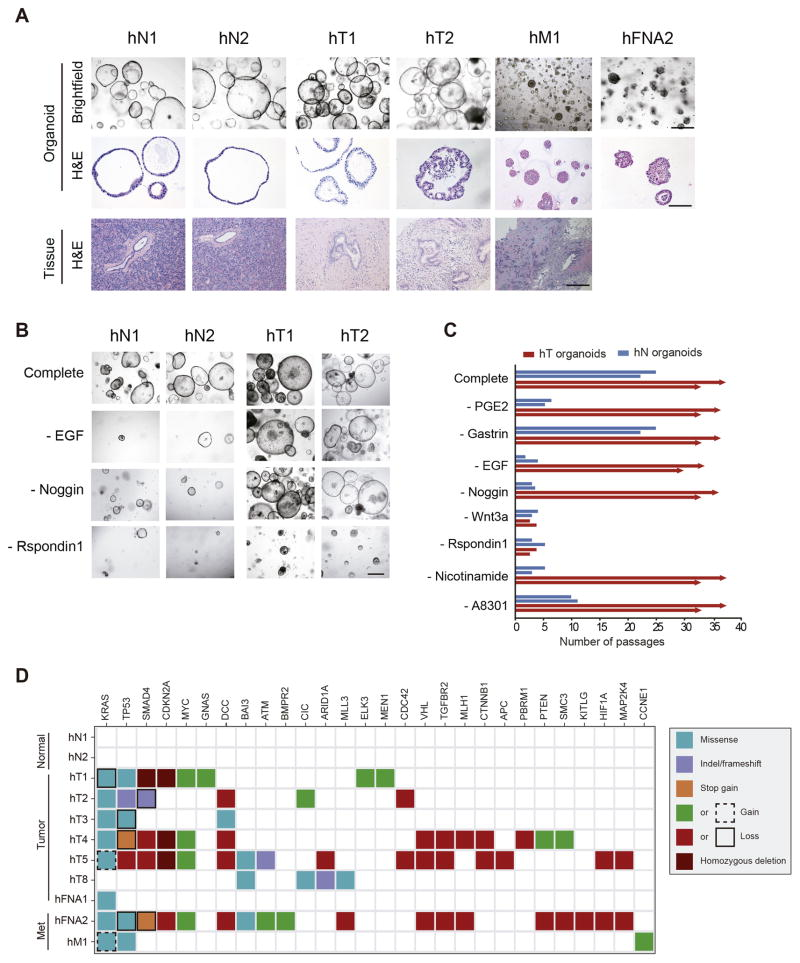
圖6:Hans Clevers團隊建立的人胰腺導管類器官概括了正常和腫瘤導管的特征
(來源:參考文獻[10])
02 胰腺癌類器官的優勢
除病理來源的類器官以外,值得注意的是,從成人胰腺分離得到的人類正常胰腺導管類器官也擁有參與病理研究的價值。本綜述中作者著重提到,雖然正常胰腺導管細胞增殖能力有限,但人類正常胰腺類器官擁有與腫瘤細胞類似的增殖速率,在保持擴增能力的同時并沒有積累惡性突變,因此可作為與腫瘤細胞對比研究差異化表達基因等腫瘤特征的平臺。
此外,胰腺類器官可以從極少的組織樣品中建立,因而跨越了胰腺癌確診晚、僅有20%胰腺癌患者適合手術切除造成的缺乏研究樣本的障礙。
總之,與難以保持上皮特征的2D細胞系相比,3D胰腺類器官可保留基底-頂端極性并建立有細胞骨架。患者來源的類器官(PDO)概括了體內腫瘤的細胞狀態并可捕獲體細胞遺傳和個體間變異以及腫瘤微環境特征,為研究胰腺癌生物學和探索潛在的治療策略提供了一個生理學相關的平臺(圖7)[11]。
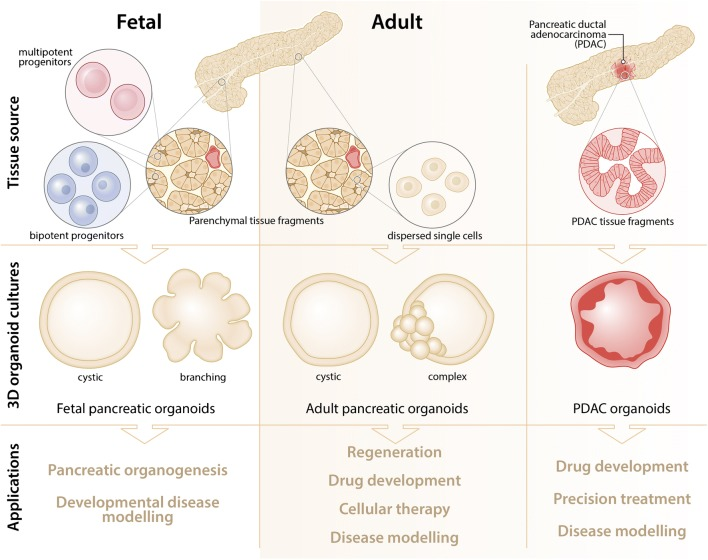
圖7:胰腺類器官的產生與應用
(來源:參考文獻[11])
03 臨床應用
如前所述,PDO已成為理想的藥物療效預測和耐藥性評估平臺。2024年法國研究團隊的前瞻性研究表明,PDAC類器官特異性為92.9%、靈敏度為83.3%,在臨床環境下具有穩健的預測價值[12]。且來源于患者的類器官保留了個體特征,允許對藥物反應進行動態追蹤評估。此外,PDO還允許大規模地對患者樣品進行多組學分析,以揭示用于預測藥物反應的不同標志物。
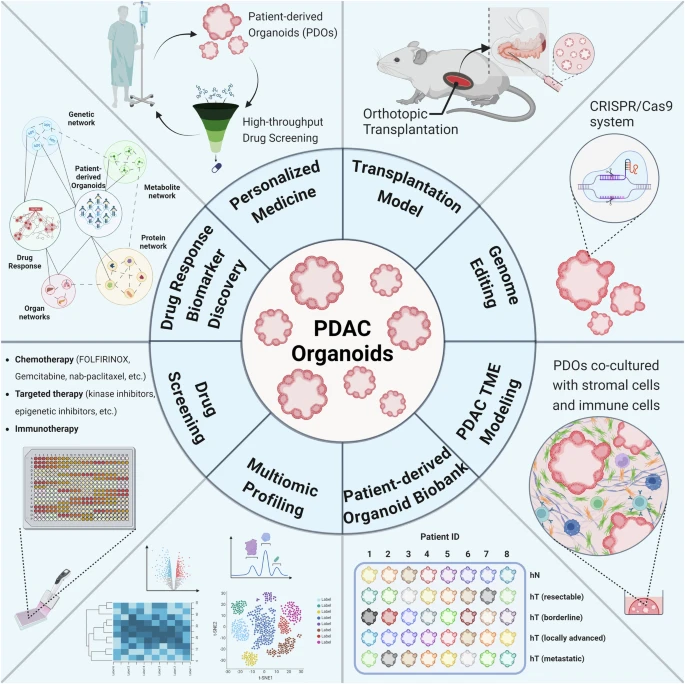
圖8:PDAC類器官的應用方向
(來源:參考資料[2])
最重要的是,類器官還可參與腫瘤機制的解讀。轉移性PDAC與原發性腫瘤具有相似的突變景觀,其轉移特性主要由表觀遺傳等調控。例如,胰腺類器官已經協助揭示了轉錄因子(如FOXA1、EN1、EVI1和TEAD2)在PDAC轉移表型中的影響[13]。澳大利亞胰腺癌基因組計劃也已利用小鼠和人PDAC類器官鑒定了階段特異性和亞型特異性DNA甲基化特征(圖9)[14]。根據以上表觀遺傳發現,還可針對不同分子亞型開發全新診斷標志物。
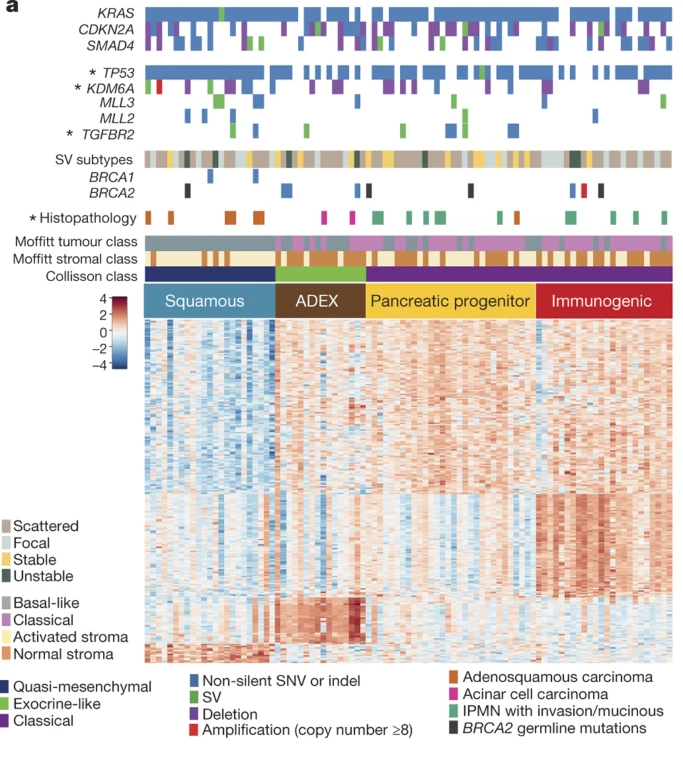
圖9:RNA-seq對PDAC的聚類分析
(來源:參考文獻[14])
04 挑戰與改良
PDAC復雜的腫瘤微環境(TME)已對藥物療效造成了困擾。譬如,活化的腫瘤相關成纖維細胞(CAFs)與沉積的富含膠原蛋白的細胞外基質(ECM)在很大程度上阻礙了PDAC藥物的有效遞送。最近已開發了PDAC類器官和各種TME細胞組分,包括CAF及免疫細胞等的共培養模型,以進一步探索細胞間相互作用在腫瘤進展中的貢獻,以及腫瘤發展過程中的免疫反應等。
PDAC還受上皮-間充質轉化(EMT)等表型可塑性驅動,具有顯著的腫瘤間和腫瘤內異質性。近日,德國慕尼黑工業大學研究團隊首次成功建立了涵蓋PDAC異質性全圖景的人源類器官模型(圖10)[15]。具體的培養方法包括去除培養基中的TGF-βRI抑制劑及Wnt3a等其他會增強上皮分化、抑制分支發生的因子,同時添加B27、FGF10、EGF、HGF、Noggin和Rspondin1等生長因子以及NAC及iCRT14等小分子。
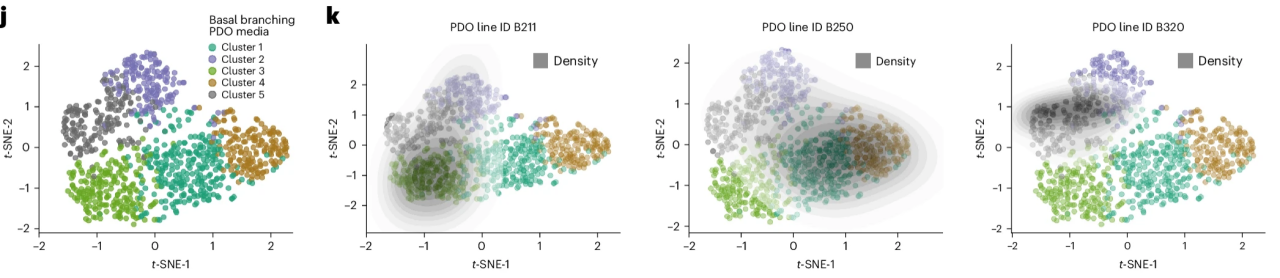
圖10:PDO的表型異質性
(來源:參考文獻[15])
低血管含量與缺氧環境也是PDAC的特征之一。與正常胰腺相比,PDAC組織的血流減少約60%。該特性同樣限制了藥物遞送效率及化療有效性。與此同時,血管形成可能促進轉移和腫瘤進展。研究人員正在積極探索血管化PDAC類器官的生成,以進一步研究血管與PDAC的關系。韓國一研究團隊通過將類器官與人臍帶靜脈內皮細胞(HUVEC)共培養形成血管微環境[16]。2020年,多倫多大學研究團隊開發了PDAC器官器官芯片血管系統,可準確再現動態TME[17]。
05 總結
胰腺類器官已成為研究胰腺發育、穩態以及良性和惡性胰腺疾病的重要橋梁。事實上,不止胰腺癌,近年來胰島類器官在生物工程和血管化技術方面的突破也已協助其在臨床前模型中證明了逆轉糖尿病的可行性[18]。不過,迄今為止尚未開發出同時包含內外分泌腺的胰腺類器官,這大大阻礙了對二者生理和病理的同時研究[19]。如何簡化當前復雜的胰腺類器官培養系統以提高效率也是改良方向之一。盡管成果喜人,但目前胰腺類器官仍處于早期階段,主要重點仍然是增強其仿生性。
