在 ex vivo CAR-T(體外CAR-T)成功驗證了細胞療法效力卻受困于其“高端定制”模式之后,in vivo CAR-T(體內CAR-T)——這種無需分離細胞、無需清淋、制備方便、采用off-shelf的生產方式,在患者體內直接生成 CAR-T 細胞的顛覆性技術——正試圖從根本上破解可及性這一最大瓶頸,成為全球藥企競相追逐的下一代療法。
近期,國內在該領域的研發突破也密集涌現。例如,虹信生物(MagicRNA)于9月在《新英格蘭醫學雜志》(NEJM)公布了基于mRNA-LNP的體內 CAR-T 臨床數據,首次從臨床層面驗證了該路徑的可行性,并在近期完成近億元Pre-A+輪融資,打破 mRNA 行業長達一年的資本寒冰期;阿法納生物亦憑借基于邏輯門控技術的體內 CAR-T 療法進入臨床階段,為解決安全性這一核心痛點提供了新思路。
這些進展勾勒出中國企業在創新格局中正從“跟跑”向“并跑”乃至局部“領跑”轉變的生動圖景。本文將全面解析 in vivo CAR-T在血液瘤、自身免疫病及實體瘤三大適應癥中的研發進展與底層邏輯,梳理全球重點管線,并探討技術路線競爭與未來趨勢。
技術路徑之爭:病毒載體長效賦能 VS mRNA-LNP靈活可控
在深入適應癥之前,理解兩大主流技術路徑的核心區別至關重要。它們代表了解決“體內 CAR-T ”這一問題的兩種不同科學路徑。
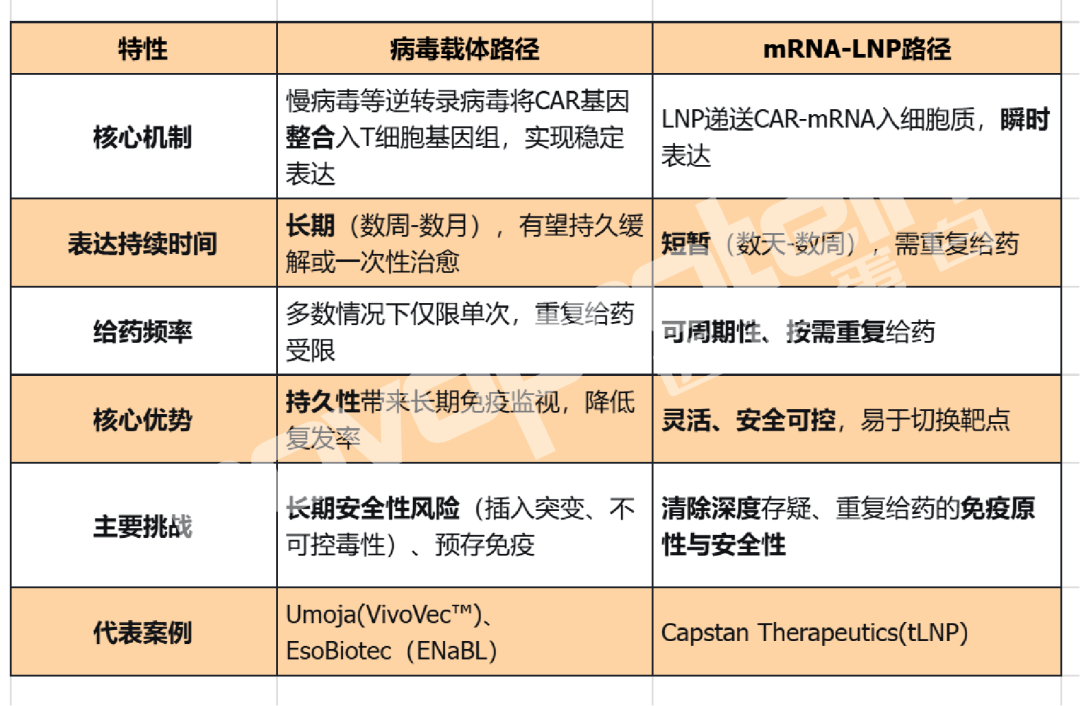
可以說,病毒路徑追求“一勞永逸”,而 mRNA 路徑主打“靈活可控”。這一根本差異,決定了它們在下列不同適應癥中的應用邏輯和前景。
三大領域應用:傳統挑戰與 In Vivo CAR 的破局之道
血液腫瘤:復發與抗原逃逸的 In Vivo CAR 升級策略
在細胞治療領域,血液系統腫瘤,尤其是B細胞淋巴瘤和白血病,是ex vivo CAR-T目前應用最為成熟且療效顯著的疾病領域。但仍存在三大關鍵挑戰:
-
不可重復性:患者復發或抗原逃逸時,原有CAR-T細胞失效,缺乏快速補救手段。
-
生產瓶頸:從采集T細胞到回輸平均需2–4周,成本高昂,部分快速進展患者可能錯失治療窗口。
-
毒性管理壓力:CRS與ICANS風險高,需住院監控。
In Vivo CAR的解法
-
病毒載體路徑(長效緩解):一次治療即可實現長期免疫監視,降低復發風險。以比利時EsoBiotec為例,其ENaBL平臺通過慢病毒載體在患者體內直接重編程T細胞,生成 BCMA CAR-T 細胞。針對多發性骨髓瘤患者的 ESO-T01 I期臨床數據顯示,首批4名患者均表現出有效治療反應,其中2人腫瘤已完全消失。該策略能夠避免傳統 ex vivo CAR-T 的生產瓶頸,同時降低因細胞失效或抗原逃逸導致的復發風險。。
-
mRNA-LNP 路徑(靈活管理):復發或微小殘留病(MRD)時,可快速再次給藥;若抗原逃逸,則可快速切換靶點(如CD19→CD22)。國內嘉晨西海(JCXH-213)、星銳醫藥(STR-P004)
等管線正在探索門診可給藥、可維持治療的模式 。
當前挑戰
-
病毒載體:持久性表達是一把雙刃劍,缺乏“關閉開關”可能導致不可逆的脫靶毒性或嚴重CRS/ICANS。預存免疫和整合突變風險亦是隱憂。
-
mRNA-LNP:瞬時表達是否足以實現深度且持久的腫瘤清除仍待驗證;此外,LNP/PEG相關免疫原性可能影響重復給藥的安全性與效率。
自身免疫性疾病:從“高風險重置”到“安全可控調節”
自身免疫性疾病(如系統性紅斑狼瘡、多發性硬化)患者群體龐大,且以年輕女性為主。傳統藥物多為廣譜免疫抑制劑,需長期甚至終身用藥,帶來累積毒副作用并嚴重影響生活質量。Ex vivo CAR療法雖能實現深度緩解甚至“一次性治愈”,但其“免疫系統重置”模式可能帶來長期免疫缺陷風險以及高昂的單次治療費用,使得臨床應用謹慎。
In Vivo CAR的解法
-
病毒載體路徑(單次給藥,旨在實現長效緩解):延續 ex vivo 的思路,通過單次給藥實現數年免疫重置。例如濟因生物(JY231)與傳奇生物(LVIVO-TaVec100)正探索在SLE等自免病中實現“一次性”長期緩解的可能。
-
mRNA-LNP 路徑(按需精準調節):通過瞬時表達,在疾病活動期短期清除B細胞,緩解后藥效迅速消退,降低長期免疫抑制風險。 Capstan Therapeutics 的 CPTX-2309 已進入I期臨床,是該領域的全球先行者。國內如虹信生物(HN2301)在SLE患者中首次實現了POC,星銳醫藥(STR-P004) 也在快速跟進。
當前挑戰
-
病毒載體:在自免病中的長期安全性是最大擔憂。CAR-T細胞長期存在可能帶來免疫系統持續受抑、B細胞重建遲緩、感染風險增高,甚至有潛在的繼發惡性腫瘤風險。
-
mRNA-LNP:核心問題在于藥效持續時間與重復給藥的安全性:一次給藥后效果持續多久?是否需要定期給藥(例如每幾個月)?頻繁給藥對免疫系統或肝臟、脾臟等器官的中短期毒性如何?目前仍待臨床驗證。
實體腫瘤:破解異質性、微環境與安全性三重壁壘
如果說在血液瘤和自免病中,in vivo CAR 是對現有療法的“優化”和“替代”,那么在實體瘤領域,它則肩負著 “從零到一”的開荒使命。
實體瘤是細胞治療的“珠穆朗瑪峰”。Ex vivo CAR-T 嘗試了多個靶點(如 GD2、GPC3、EGFRvIII),雖驗證了安全性,但療效仍受制于三重壁壘:
-
腫瘤異質性:單靶點 CAR 無法清除所有腫瘤細胞,抗原陰性克隆迅速逃逸。
-
免疫抑制微環境(TME):腫瘤組織物理屏障重重,且充滿 PD-L1、TGF-β 等抑制因子,致使CAR細胞難以浸潤并迅速耗竭。
-
on-target off-tumor毒性:實體瘤相關抗原(TAA)在正常組織有低水平表達,導致致命性的脫靶毒性,攻擊正常組織帶來嚴重風險[1]。
此外,ex vivo CAR 路徑的困境在于,其“活藥物”的特性放大了這些挑戰: 體外制備的 CAR-T 細胞是一支“一次性”的常備軍,一旦回輸,其數量、活性和命運難以再被精確調控。若遭遇強抑制TME,大軍會迅速衰竭;若發生脫靶毒性,則無法“召回”,只能等待其自行消亡。
In Vivo CAR的解法
相對而言,in vivo CAR 策略提供了一種全新的范式:它不再依賴于回輸一支制備好的“軍隊”,而是向體內投送“智能軍火庫”(病毒或LNP),在患者自身的“主場”(脾臟、淋巴結、甚至腫瘤內部)就地武裝T細胞,提供了靈活性與可控性。
病毒載體路徑(長效表達與精準感染):
-
靶向遞送工程化:通過改造病毒衣殼/包膜,使其更高效、更特異性地感染T細胞。例如 Interius 利用 CD7 binder 提高T細胞特異性感染效率; EsoBiotec 的 ENaBL 平臺則通過納米抗體(VHH)模塊實現對 TCRα/β T 細胞的可編程化靶向。這類策略已在動物模型中顯示顯著增強的轉導效率,但仍處于早期驗證階段。
-
瘤內或局部給藥:通過局部注射(如瘤內、胸腔灌注),可增加病毒在腫瘤組織的濃度,從而提升 CAR-T 浸潤效率并降低系統性毒性。例如,易慕峰生物開發的 MxV-G 假型慢病毒在非清髓小鼠模型中實現了>4 周的 B 細胞清除,但尚未進入臨床階段。
mRNA-LNP 路徑(安全可控+快速迭代):其瞬時性在實體瘤中從“理論劣勢”變為“戰略優勢”,實現了ex vivo無法做到的動態管理。
-
多靶點序貫治療:有望克服腫瘤異質性。例如,首輪靶向 Claudin 18.2 的 mRNA-LNP 治療后若出現抗原逃逸,后續療程可迅速切換為靶向 B7-H3 或 GPC3 的 mRNA-LNP,無需重新制備細胞,縮短治療間隔。
-
瞬時表達:持續約 3–7 天,可避免因長期表達導致的“非靶毒性”或“抗原非依賴激活”;若首輪治療出現抗原逃逸,可在停藥后快速啟動第二輪不同靶點的 mRNA-LNP 治療,無需等待CAR-T細胞衰減或清除。
-
細胞特異性遞送:通過 LNP表面修飾CD3/CD8靶向配體,可顯著提高 mRNA 對 T細胞的遞送效率。
當前挑戰
-
病毒載體:在實體瘤中風險更高:實體瘤相關抗原(TAA)在某些正常組織上低水平表達,長期且不可逆表達的 CAR-T(尤其整合型載體)可能引起 on-target off-tumor 毒性。如何精確控制表達量、作用時間或有“關閉開關/可逆性”調控,是設計中非常重要的科學難題。 另外,在實體瘤中向腫瘤內部浸潤與轉導足夠數量的 T 細胞是技術瓶頸;病毒載體在這方面常因物理屏障(血管、基質、TME 抑制性細胞)與分布體積問題而效率低。
-
mRNA-LNP :短暫存在可能不足以清除頑固實體瘤,需頻繁給藥或聯合治療,而LNP的天然肝向性(肝臟偏好分布)與載體成分清除路徑可能導致在腫瘤 /外周組織中遞送效率降低以及較高的安全性問題(肝臟累積毒性、 off-target分布等)。靶向修飾(如T-細胞靶向LNP、表面配體改造)和局部注射策略仍在探索中。
全球I期/IIT In Vivo CAR管線(截至2025年9月)
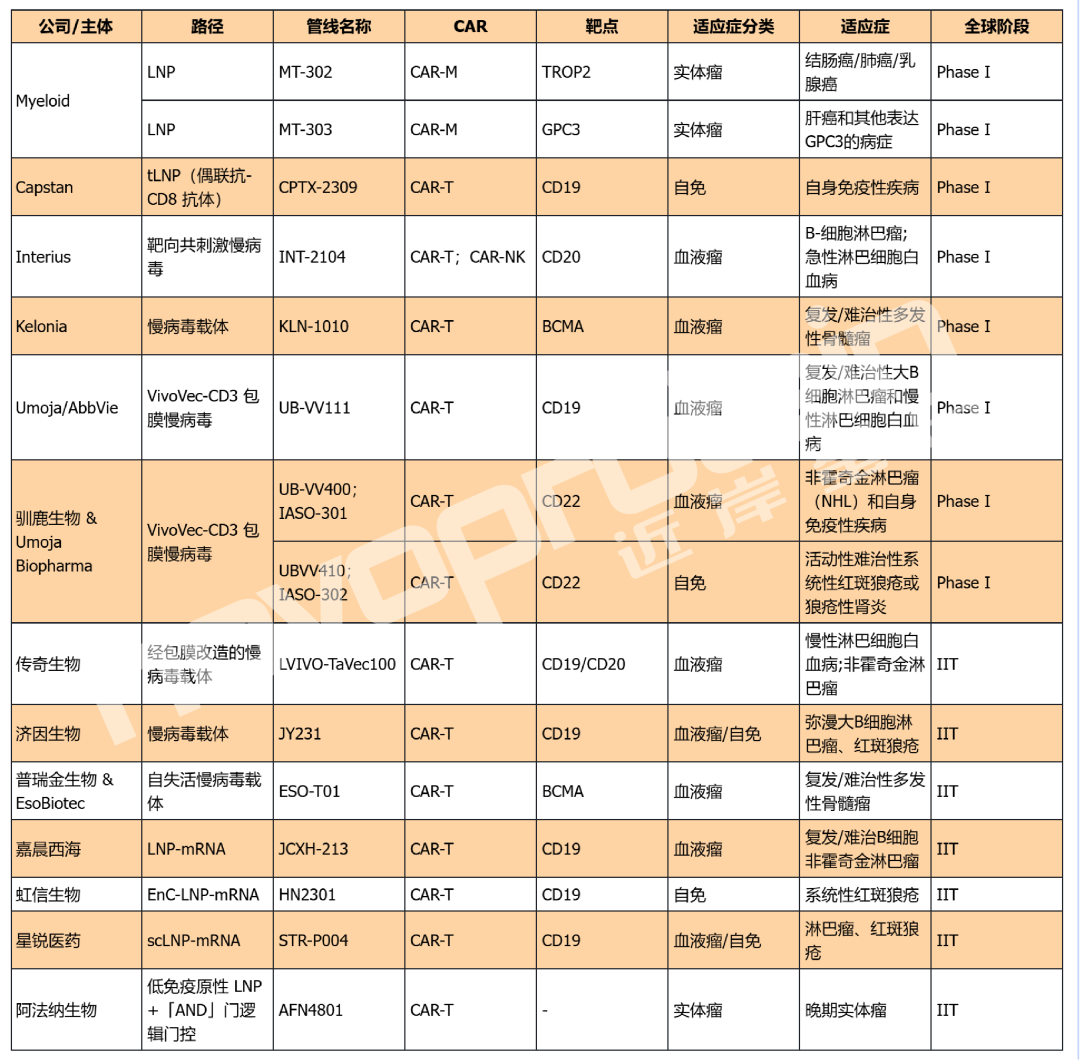
(novoprotein整理,如有錯漏,歡迎指正)
共性問題:從工藝放大到質量控制的產業化挑戰
除了上述針對不同適應癥的科學挑戰,in vivo CAR療法邁向產業化還面臨一個橫跨所有技術路徑的共性難題:大規模生產的重現性與嚴格的質量控制。
無論是病毒載體還是mRNA-LNP,其生產過程都極為復雜。病毒載體的滴度、純度、空殼率,mRNA-LNP的包封率、粒徑均一性、以及核心指標——能夠成功修飾T細胞并表達CAR的陽性率(Transduction/Transfection Efficiency)——都需要在放大生產(Scale-up)時得到精確控制。任何批間差異都可能直接導致臨床療效的不穩定,這是將其從實驗室的“概念驗證”轉化為可惠及廣大患者的“標準化藥品”必須翻越的一座大山。
未來方向:聯合策略與工程化創新
由于實體瘤的復雜性與異質性,單一技術路徑難以實現完全突破,未來in vivo CAR的發展將聚焦以下方向[2]:
聯合免疫調控
與免疫調節劑(如PD-1抑制劑、IL-12 mRNA)聯合使用,逆轉 TME 免疫抑制狀態。mRNA-LNP的瞬時表達特性尤其適合此類組合,可在提供足夠免疫刺激的同時控制毒性風險。
邏輯門控設計[3]
通過分子電路賦予 CAR-T 條件性激活能力:
-
-
「AND」門:可要求T細胞在同時識別兩種腫瘤抗原后才被激活。
-
-
-
「NOT」門:遇到腫瘤抗原激活,遇到正常組織抗原時觸發抑制。
-
-
-
級聯門控(如SynNotch):先識別抗原 A,再誘導生成抗原 B 的 CAR,實現空間特異性。
-
可進一步疊加“藥物開關”“自殺開關”,增強可控性。這不僅為患者提供了安全兜底,顯著降低on-target off-tumor毒性,也為產品的監管審批和商業成功奠定了堅實基礎。國內阿法納生物的AFM4801管線正是這一方向的代表。
遞送方式創新
通過瘤內注射或局部區域給藥(如胸腔灌注),可提高有效濃度,增強CAR-T細胞浸潤與抗腫瘤效果。
新型效應細胞
除T細胞外,還可改造巨噬細胞(CAR-M),利用其天然浸潤與抗原呈遞優勢,如Myeloid的MT-302/GPC3-CAR-M。
生產工藝的創新與標準化
克服產業化挑戰的關鍵在于將“手工定制”轉化為“標準化生產”。這依賴于上下游工藝的全面創新:
-
-
平臺化工藝開發:建立適用于不同靶點CAR的病毒載體/mRNA-LNP平臺化生產工藝,減少從頭開發的時間與成本,提高批間一致性。
-
-
-
先進過程分析技術(PAT)與質量控制:引入在線監測和快速放行檢測方法,對關鍵質量屬性(CQAs),如病毒載體基因組滴度、mRNA-LNP的包封率與CAR陽性率,進行實時、精準的控制,確保每一批產品的有效性和安全性。
-
-
-
封閉式、自動化的生產系統:采用一次性生物反應器和自動化設備,減少人為干預和污染風險,是實現大規模、高重現性生產的必由之路。
-
這些策略的共同目標,是在提升療效的同時增強可控性、安全性與生產可行性,從而加速 in vivo CAR-T 的臨床落地與商業化。
近岸蛋白:為全球創新者提供研發解決方案
依托NovoiSMART® 多策略抗體發現平臺及RNA設計與開發技術平臺,提供面向 in vivo CAR 領域全面的技術服務與產品,涵蓋CAR分子發現與特異性靶向抗體篩選、RNA設計與合成、Ab-tLNP偶聯工藝開發、CAR-RNA-tLNP生產及藥效評估,助力合作伙伴加速創新轉化,共同推動細胞與基因治療邁向新階段。
掃碼申領《In Vivo CAR研發解決方案》實體書:

結語
全球 in vivo CAR-T 研發正進入空前活躍的臨床驗證期。病毒載體與mRNA-LNP雙軌并行,適應癥擴展至自免與實體瘤,競爭格局日趨明朗。最終勝出者,將是能解決靶向遞送、可控性與生產工藝三大挑戰的團隊。
近岸蛋白愿以高性能工具與定制化服務,成為創新者可靠的伙伴,共同推動這一顛覆性療法早日落地。
參考文獻
[1] B. Du, J. Qin, B. Lin, J. Zhang, D. Li, and M. Liu, “CAR-T therapy in solid tumors,” Cancer Cell, vol. 43, no. 4, pp. 665–679, Apr. 2025, doi: 10.1016/j.ccell.2025.03.019.
[2] T. A. Bui, H. Mei, R. Sang, D. G. Ortega, and W. Deng, “Advancements and challenges in developing in vivo CAR T cell therapies for cancer treatment,” eBioMedicine, vol. 106, p. 105266, Aug. 2024, doi: 10.1016/j.ebiom.2024.105266.
[3] “Advancing CAR T Cell Therapy with Logic Gate Engineering.” Accessed: Sep. 22, 2025. [Online].
