前兩期我們分別解析了Cas蛋白家族的剪切奧秘,sgRNA的設計方法和體外合成技術,相信小伙伴們已經確認好需要的Cas蛋白和sgRNA序列,那么如何精準的將他們(大分子復合物)運送至靶細胞,啟動CRISPR/Cas系統敲入或敲除目的基因呢?本文我們將系統解析CRISPR/Cas遞送形式和各類轉染技術,并深入探討其原理、操作流程及優缺點,幫助大家完成基因編輯技術的“最后一公里”。
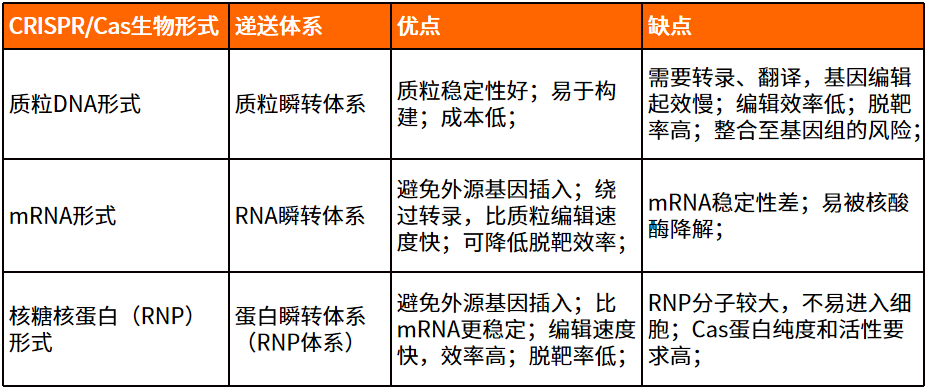
在選擇CRISPR/Cas系統的遞送技術之前,首先得確認Cas蛋白和sgRNA的生物形式,它有3種不同的生物形式能被遞送至細胞內,分別是質粒DNA、mRNA和核糖核蛋白(RNP)形式。
質粒DNA形式
pDNA(質粒DNA)是 CRISPR/Cas系統最常用的一種形式。以最主流的CRISPR/Cas9系統為例,首先設計CRISPR質粒DNA,包含啟動子、Cas9基因序列、sgRNA序列等。之后通過轉染技術,讓質粒在NLS的幫助下進入細胞核,通過轉錄形成Cas9 mRNA和sgRNA,Cas9 mRNA被轉移到細胞質中翻譯成Cas9蛋白,隨后Cas9蛋白與sgRNA結合形成復合物,啟動后續的基因編輯。
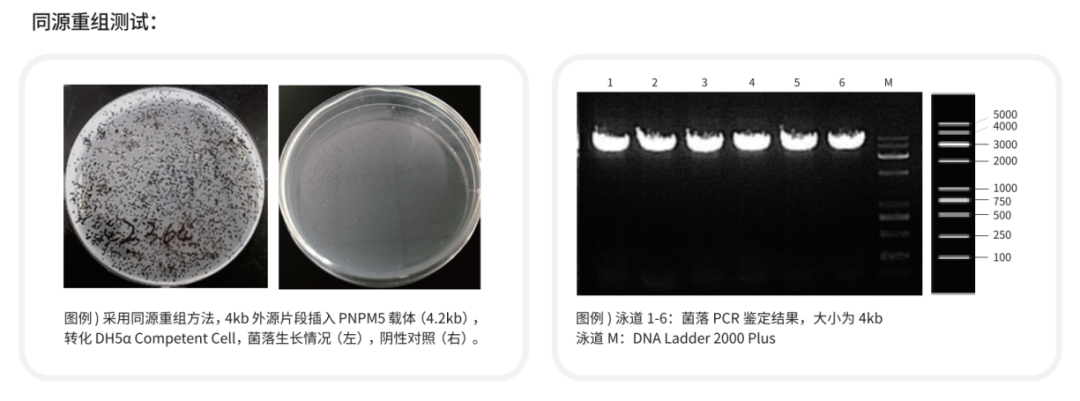
近岸蛋白提供CRISPR質粒構建時需要的同源重組克隆試劑盒(Cat.No.NR005),能做到1-5片段無縫克隆,最快僅需10min完成克隆連接,無假陽性,菌落數多。
|
|
|
|
|
|
|
|
|
|
mRNA形式
mRNA形式的工作原理是通過體外轉錄技術(IVT)在體外合成Cas9 mRNA以及sgRNA,并進行化學修飾,包括5’端加帽、核苷酸修飾(如假尿苷修飾)及3’端Poly(A)尾等。mRNA直接進入細胞質,繞過轉錄步驟,由核糖體立即翻譯為功能蛋白。同時遞送的修飾sgRNA與新生Cas9快速組裝成復合物,切割靶DNA。其優勢在于瞬時表達,通過核苷酸修飾(如N1-甲基假尿苷)降低免疫原性,但需LNP等載體保護免受核酸酶降解。
近岸蛋白研發的Cas9 mRNA (N1-Me-Pseudo UTP) (Cat.No.MR019)不僅在N端和C端分別加入核定位信號NLS,提高DNA切割速率,并且加入N1-甲基假尿苷替換原有的UTP,有效降低mRNA在哺乳動物細胞中表達的免疫原性,增強mRNA的穩定性。
CRISPR/Cas9系統mRNA形式產品推薦
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
產品性能
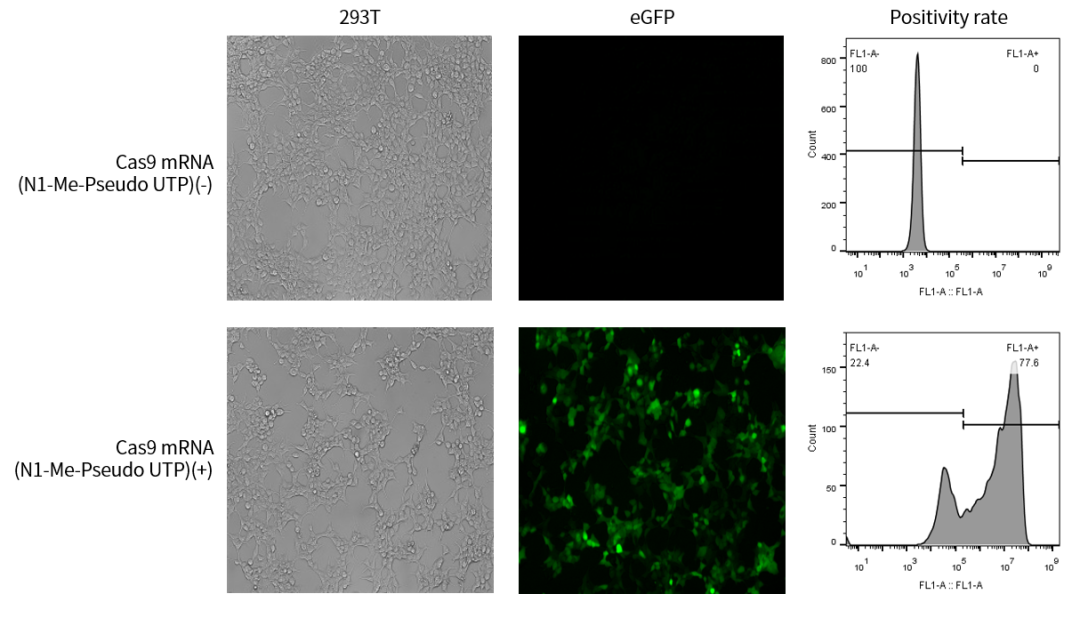
圖例)Cas9 mRNA (N1-Me-Pseudo UTP)轉染24h后,293T細胞中的編輯效果,細胞因Cas9活性發出綠色熒光,簡單快速,mRNA轉染效率穩定。
核糖核蛋白(RNP)形式
核糖核蛋白是指Cas9蛋白與sgRNA的復合物,又稱為RNP。首先在體外合成Cas9蛋白和sgRNA,并將他們結合形成RNP復合物,之后作為單個貨物直接通過電轉或者脂質體等轉染技術遞送至細胞中,避免了與pDNA或mRNA遞送相關的許多陷阱,如pDNA會有整合至基因組的風險,mRNA穩定性差等。RNP遞送無需細胞內轉錄和翻譯,因此可實現最快速的基因組編輯。
近岸蛋白專門為CRISPR/Cas系統的RNP體系開發的Cas蛋白及其突變體,不僅含有NLS核定位信號,蛋白純度≥95%,活性高,體外切割效率達90%,內毒素低,能在72h內完全降解,可有效降低脫靶效應,提高基因編輯敲入或者敲除的效率。再加上通用型一步法sgRNA體外轉錄試劑盒(Cat.No.E399),快速制備CRISPR/Cas系統所需的兩大元件,可以實現即時快速的基因編輯。
CRISPR/Cas系統RNP形式產品推薦
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
AaCas12bMax |
臨床級、零脫靶 |
GMP-E375 |
|
|
E375 |
|
||
|
MR205 |
|
||
|
enCas12hf/Ultra系列 |
臨床級、高編輯效率 |
E385 |
enCas12hf |
|
E393 |
enCas12Ultra |
||
|
|
enCas12hf Enhanced mRNA (N1-Me-Pseudo UTP) |
||
|
MR208 |
enCas12Ultra mRNA (N1-Me-Pseudo UTP) |
||
|
Cas13a |
RNA內切酶 |
E381 |
LwaCas13a Nuclease |
|
|
|
|
|
|
|
|
|
遞送技術
大家了解了CRISPR/Cas系統的生物形式,那么如何將這些不同的CRISPR/Cas系統生物形式遞送至細胞中呢?這就需要通過不同的遞送技術,包括物理轉染法、化學轉染法和病毒載體轉染法。
物理轉染法
01 顯微注射法
顯微注射法是指在顯微鏡下將微量的核酸通過專門的儀器注射到細胞的細胞質或細胞核中,從而實現核酸的導入。其操作流程是制備RNP體系/mRNA/Cas9質粒,使用顯微注射儀注入細胞中,培養并分析編輯效率。該技術最重要的用途是將核酸引入卵母細胞、卵細胞和動物胚胎中,常用于制備轉基因動物和基因瞬時表達分析。
02 電穿孔法
電穿孔法是將細胞暴露在短暫的高場強脈沖電場中,通過在細胞膜上打孔而將核酸導入細胞的方法。其操作流程是將細胞與CRISPR組分(RNP或Cas9質粒)混合,加入電穿孔緩沖液,施加脈沖電壓,即可瞬轉至細胞中。脈沖的大小和持續時間決定了轉染效率,對于不同的細胞系,必須經過優化驗證來確定電轉條件,該方法轉染效率高,適用性廣,不受細胞種類的限制,但是需要昂貴的儀器進行實驗,且細胞死亡率較高。
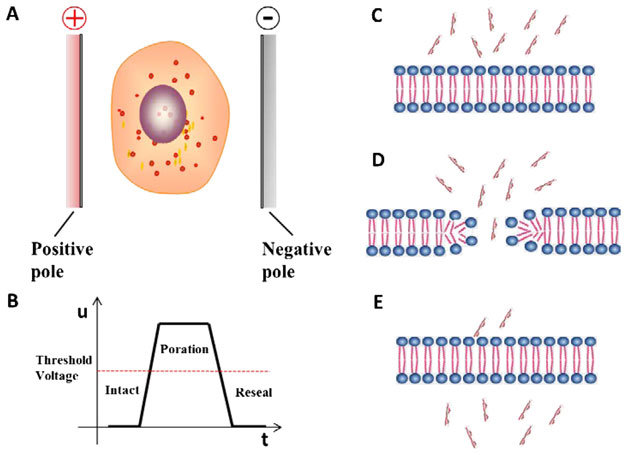
電穿孔法瞬時轉染原理圖
(Du, Xiaofan & Zhou et al. 2018)
化學轉染法
01 DEAE-葡聚糖法
DEAE-葡聚糖是最早開發的轉染試劑之一。它是一種可溶的聚陽離子碳水化合物,通過與帶負電的DNA結合形成聚集物。適用于Cas9質粒DNA的遞送。攜帶正電荷的復合物與帶負電荷的細胞膜結合,使復合物通過細胞的內吞作用進入細胞中。
02 磷酸鈣法
該技術通過將磷酸鹽溶液和含有DNA的氯化鈣溶液進行緩慢混合,形成DNA-磷酸鈣共沉淀復合物。適用于Cas9質粒DNA的遞送。復合物能粘附于細胞膜上,通過細胞內吞作用進入細胞中。
03 陽離子脂質體法
脂質體分為單層脂質體和多層脂質體。常用的陽離子脂質體與帶負電的DNA結合,形成DNA-陽離子脂質體復合物,從而吸附到帶負電的細胞膜表面,通過細胞內吞作用進入細胞。其操作流程是將Cas9質粒或mRNA與脂質體混合,孵育形成脂質體-核酸復合物,加入細胞培養液,37°C孵育24-48小時,檢測編輯效率。
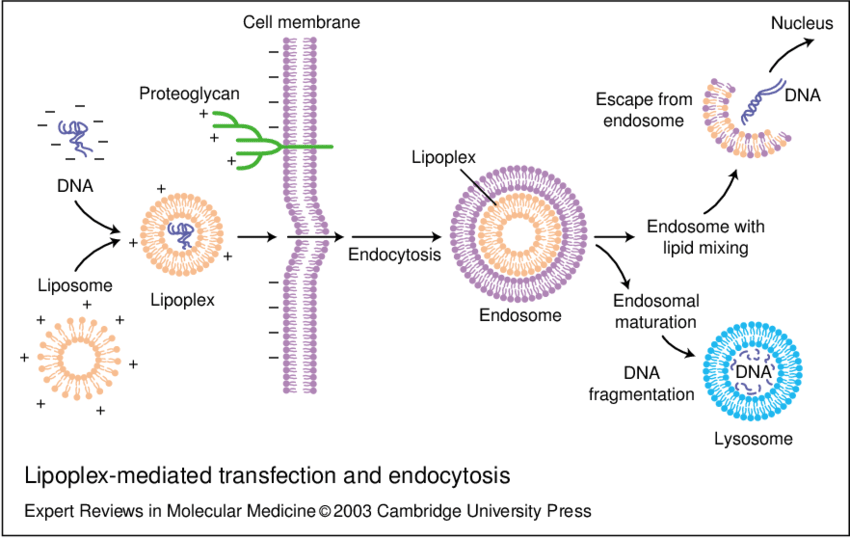
脂質體瞬時轉染原理圖(Parker et al. 2003)
化學轉染法能夠在活體內應用,對細胞毒性較低且細胞存活率較高、實驗重復性好。適用性廣,已經被廣泛用于將pDNA和mRNA轉移到細胞中,在很多細胞中能得到有效的瞬時轉染和穩定轉染效果。但是該試劑有著難以自制,價格較為昂貴,轉染效果在不同細胞類型中差異較大等缺點。
病毒轉染法
01 慢病毒
慢病毒載體系統是一種能非常高效地把外源基因穩定整合到哺乳動物細胞中的載體工具。除了常規質粒轉染外,目前該系統也是把外源基因轉入哺乳動物細胞的最常用方法之一。由于具有目的基因和啟動子選擇的靈活性以及轉染細胞類型的廣泛性兩大特點,使其成為應用范圍較廣的外源基因表達系統。慢病毒載體來源于人類免疫缺陷病毒HIV,屬于逆轉錄病毒家族,而目前通過改造優化,慢病毒載體刪除了與病毒包裝和轉導相關的基因,因而具有很高的生物安全性。適用于Cas9質粒DNA的遞送。
當病毒轉導靶細胞時,釋放到宿主細胞中的病毒RNA借助逆轉錄酶逆轉錄成雙鏈DNA,然后隨機整合進宿主細胞的基因組中。在病毒載體中,位于兩個LTR的DNA片段和病毒基因組都會穩定整合到靶細胞的基因組中。
02 腺病毒
腺病毒載體是應用較為廣泛的病毒載體系統。腺病毒對大多數細胞都有很高的感染效率,包括分裂和不分裂細胞及原代細胞,除了卵細胞以外幾乎在所有已知細胞中都不整合到染色體中,因此不會干擾其它的宿主基因。當腺病毒轉導宿主細胞時,兩個ITR之間的外源DNA及病毒基因組一起進入細胞,并以游離DNA的形式存在于細胞核中。由于腺病毒基因組不整合到宿主的基因組,所以腺病毒在宿主體內是瞬時表達。適用于Cas9質粒DNA的遞送。
03 腺相關病毒
腺病毒相關病毒(adenovirus associated virus,AAV)是一類無包膜的單鏈線狀DNA病毒。具有安全性高、免疫原性低、宿主范圍廣、表達穩定等特點,被視為最有前途的基因轉移載體之一。當病毒轉導宿主細胞時,兩個ITR之間的外源DNA及病毒基因組一起進入細胞,線性雙鏈DNA基因組以游離DNA的形式存在于細胞核中。其具有多種血清型,各種不同血清型的AAV載體的主要區別是衣殼蛋白不同,因此對不同的組織和細胞的轉染效率存在差異。值得注意的是,AAV載體的最大包裝容量僅為4.7kb,因此適用于Cas9質粒DNA的遞送。如果需要遞送體積龐大的Cas9蛋白即RNP體系時,需要使用體積較小的SaCas9蛋白或者將遞送系統分割為兩個載體等。
SaCas9蛋白產品推薦
|
|
|
|
|
|
|
|
|
|
綜合各病毒載體的特性,病毒載體較其他非病毒載體體系的優勢在于較高的轉染效率,尤其是在原代細胞和干細胞中,轉染效率依然可以接近100%,可廣泛適用于體內實驗和體外實驗,具有良好的泛用性。病毒載體劣勢在于搭載的基因片段大小受限于病毒衣殼的結構大小,大片段基因難以通過這種技術導入細胞,病毒包裝技術較為復雜、存在一定的生物安全問題。
通過不同的遞送方式完成CRISPR/Cas系統的“最后一公里”,是影響基因編輯效率的關鍵。從電穿孔脈沖參數的毫秒級優化,到AAV衣殼的定向進化,遞送技術的創新正不斷拓展CRISPR的應用疆界。希望大家能根據自身的實驗選擇合適的Cas蛋白-sgRNA的生物形式,并選擇適合的遞送技術完成基因編輯實驗。既然已經將基因編輯系統遞送至細胞中啟動編輯,那么要如何檢測基因編輯后的效率呢?下期近岸蛋白將詳細解析CRISPR/Cas系統的編輯效率驗證技術!
近岸蛋白能提供基因編輯系列產品的全套解決方案
CRISPR/Cas系統相關產品推薦表
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
