腺病毒感染細(xì)胞的原理是通過纖突蛋白和細(xì)胞表面CAR結(jié)合。腺病毒黏附之后,五鄰體蛋白上的精氨酸-谷氨酸-天冬氨酸與細(xì)胞表面的整合素αvβ3和αvβ5結(jié)合并相互作用使腺病毒進(jìn)入細(xì)胞。Ad5腺病毒的高效感染依賴于細(xì)胞膜上的CAR和αvβ整合素,但是有些免疫細(xì)胞的細(xì)胞膜上缺乏這些受體,通過研究發(fā)現(xiàn)F35血清型對造血干細(xì)胞有很強(qiáng)的靶向性,因此,嵌合型Ad5/F35由此產(chǎn)生。
對于Ad5/F35的感染效率,可以參考下面這些文獻(xiàn)中Ad5/F35的具體感染效果。
轉(zhuǎn)導(dǎo) Ad5F35-eGFP 24 小時(shí)后骨髓間充質(zhì)干細(xì)胞的轉(zhuǎn)染效果圖[1]
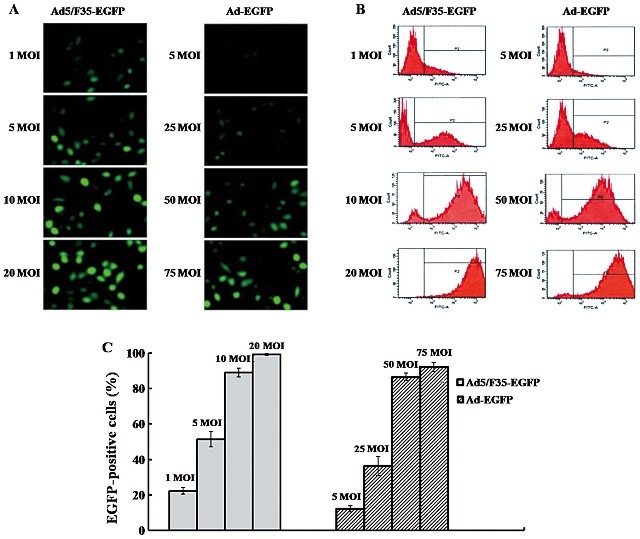
SMMC-7721 細(xì)胞感染了 Ad5-EGFP 或 Ad5/F35-EGFP 的效果圖[2]
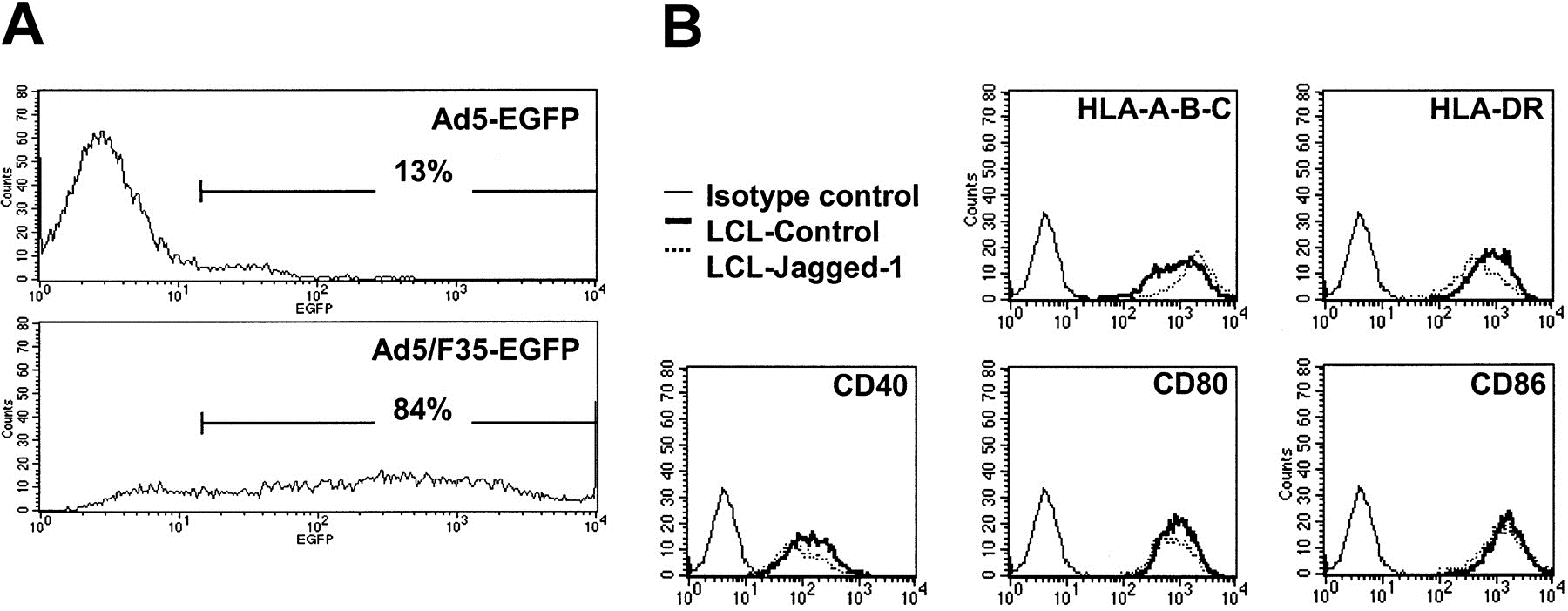
EBV-LCL 細(xì)胞中 Ad5 和 Ad5/F35 感染性的比較[3]
基于此,吉?jiǎng)P基因開發(fā)了一種嵌合型的腺病毒Ad5/F35,對于造血干細(xì)胞的靶向性大大增強(qiáng)。對于改造的原理方面,我們需要先了解一下腺病毒Ad5的結(jié)構(gòu):腺病毒是一種雙鏈線性的DNA病毒,其基因組長度約36kb。基因組兩端各有一個(gè)103bp的反向重復(fù)序列(ITR),參與病毒DNA的復(fù)制;Adv是一種無包膜的DNA病毒,其復(fù)制不依賴于宿主細(xì)胞的分裂,有50余種血清型,大多數(shù)腺病毒載體基于血清型2和血清型5,通過轉(zhuǎn)基因的方式取代E1和E3基因,降低病毒的復(fù)制能力。下面是人類血清型5型腺病毒基因組的示意圖:
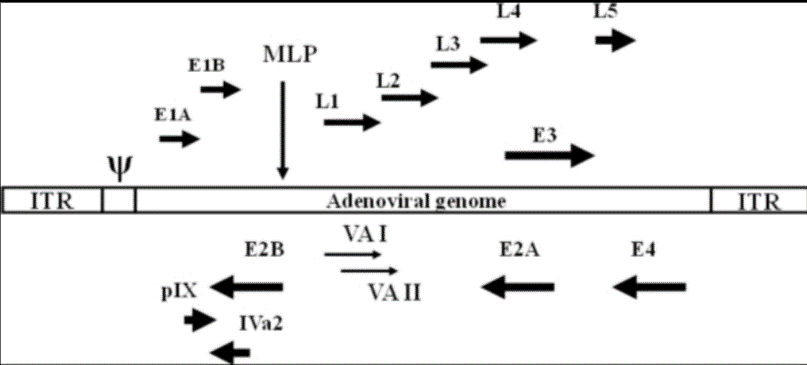
人腺病毒血清型5的轉(zhuǎn)錄圖譜[4]
嵌合型的腺病毒Ad5/F35,在Ad5的基礎(chǔ)上,其受體結(jié)合位置的纖突改造成了F35型的纖突,下圖是Ad5/F35的結(jié)構(gòu)圖。
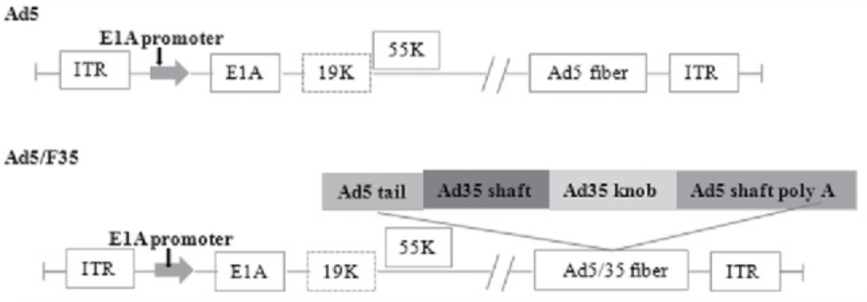
Ad5和 Ad5/F35 的結(jié)構(gòu)圖[5]
下圖是我們根據(jù)不同的文獻(xiàn)[6-9],總結(jié)的對于不同的細(xì)胞Ad5/F35的MOI的推薦值。因?yàn)椴煌募?xì)胞和以及實(shí)際操作的不同,建議各位老師根據(jù)推薦的MOI做相關(guān)預(yù)實(shí)驗(yàn)確定實(shí)際感染的MOI。

下面根據(jù)一篇文獻(xiàn)Chimeric Ad5.F35 vector evades anti-adenovirus serotype 5 neutralization opposing GUCY2C-targeted antitumor immunity[10],我們可以了解一下嵌合腺病毒載體 (Ad5/F35) 誘導(dǎo)對腫瘤相關(guān)抗原鳥苷酸環(huán)化酶 C (GUCY2C) 的免疫反應(yīng)的能力。
Ad5介導(dǎo)基因轉(zhuǎn)移和誘導(dǎo)有效免疫反應(yīng)的能力使其成為針對癌癥和傳染病的實(shí)驗(yàn)性疫苗的流行載體。由于 Ad5 感染在許多人群中流行,因此全球 >70% 的人口中預(yù)先存在的 NAb 限制了基于 Ad5 的疫苗策略。這些考慮凸顯了改進(jìn)載體的必要性,所以研究人員試圖通過用罕見的腺病毒血清型 Ad35替換 Ad5 纖毛來克服預(yù)先存在的 Ad5 NAbs,以提高表達(dá)胃腸道 (GI) 癌癥抗原鳥苷酸環(huán)化酶 C (GUCY2C) 的小鼠模型中的抗腫瘤免疫力。該試驗(yàn)表明,人源化版本的疫苗(Ad5-GUCY2C-PADRE)在常規(guī)治療后安全地誘導(dǎo)了結(jié)直腸癌患者的GUCY2C特異性CD8 T細(xì)胞反應(yīng)。然而,在接種 Ad5-GUCY2C-PADRE 疫苗后,具有高 NAb 對 Ad5 的預(yù)先存在的滴度的患者未能產(chǎn)生 GUCY2C 特異性免疫。為了克服 Ad5 NAbs,研究人員生成了一種嵌合 Ad5 載體,該載體具有 Ad35 纖毛 (Ad5/F35),在小鼠和人類中具有與 Ad5 相當(dāng)?shù)陌踩院涂鼓[瘤活性以及對 Ad5 NAbs 的抗性。這種嵌合疫苗可以轉(zhuǎn)化為胃腸道癌癥患者,不僅可以在Ad5免疫力低的患者中,而且在已有的Ad5 NAbs高的患者中安全地誘導(dǎo)GUCY2C特異性免疫。
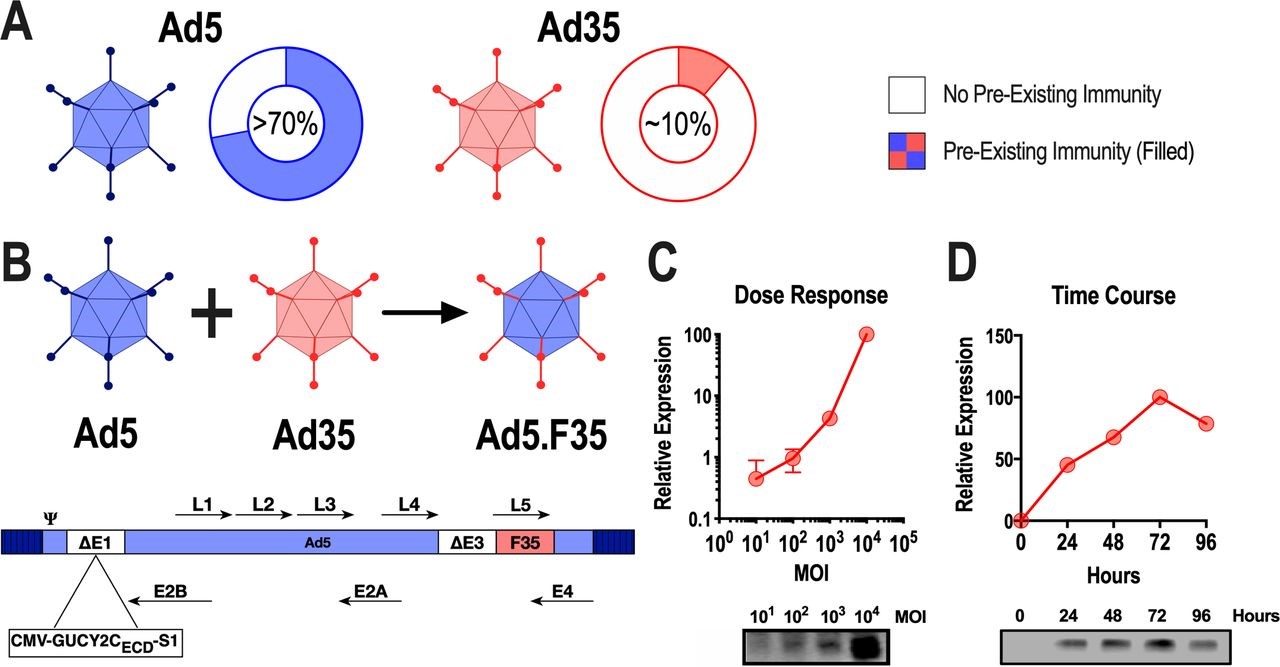
Ad5.F35-GUCY2C-S1的構(gòu)建和抗原表達(dá)
先前的研究表明,Ad5-GUCY2C疫苗在轉(zhuǎn)移性結(jié)直腸癌小鼠模型中誘導(dǎo)了保護(hù)性抗腫瘤CD8 T細(xì)胞反應(yīng)。因此,用表達(dá)GUCY2C-S1的Ad5或Ad5.F35對BALB/c小鼠進(jìn)行免疫,并在7天后用表達(dá)GUCY2C和螢火蟲熒光素酶的CT26結(jié)直腸癌細(xì)胞進(jìn)行攻擊。如前所述,Ad5疫苗接種幾乎消除了轉(zhuǎn)移性腫瘤負(fù)荷,延緩了疾病進(jìn)展,并提高了生存率。同樣,Ad5.F35也降低了腫瘤負(fù)荷、疾病進(jìn)展和延長生存期。重要的是,基于Ad5和基于Ad5/F35的GUCY2C疫苗在減輕腫瘤負(fù)荷、防止疾病進(jìn)展和促進(jìn)生存方面的功效相同。
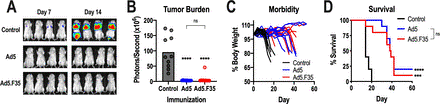
Ad5-GUCY2C-S1 和 Ad5.F35-GUCY2C-S1 的抗腫瘤功效
參考文獻(xiàn)…
1.Pablo Bosch, Scott L. Pratt, et al., Isolation, Characterization, Gene Modification, and Nuclear Reprogramming of Porcine Mesenchymal Stem Cells. Biol Reprod,2005. 74(1):46-57.
2.Yanping Cun, et al., Combined use of adenoviral vector Ad5/F35-mediated APE1 siRNA enhances the therapeutic efficacy of adenoviral-mediated p53 gene transfer in hepatoma cells in vitro and in vivo., Oncol Rep. 2013 Jun;29(6):2197-204.
3. Eric S Yvon, Stephane Vigouroux., Overexpression of the Notch ligand, Jagged-1, induces alloantigen-specific human regulatory T cells., Blood. 2003 Nov 15;102(10):3815-21.
4. Vetrini, F. and P. Ng, Gene Therapy with Helper-Dependent Adenoviral Vectors: Current Advances and Future Perspectives. Viruses, 2010. 2(9): p. 1886-1917.
5. Yang, M., et al., A novel fiber chimeric conditionally replicative adenovirus-Ad5/F35 for tumor therapy. Cancer Biology & Therapy, 2017. 18(11): p. 833-840.
6. Kai Wabg, Jian-Qinag Peng, et al., Transfection efficiency of adenoviral vector AD5/F35 to malignant hematopoietic cells of different origins. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2006 Jun;14(3):525-8.
7. Marie-Pierre Cayer, Mathieu Drouin, et al., Comparison of promoter activities for efficient expression into human B cells and haematopoietic progenitors with adenovirus Ad5/F35. J Immunol Methods. 2007 Apr 30;322(1-2):118-27.
8. P Yotnda , H Onishi, H E Heslop, et al., Efficient infection of primitive hematopoietic stem cells by modified adenovirus. Gene Ther. 2001 Jun;8(12):930-7.
9. Akira Itoh, Takashi Okada, et al., A soluble CAR-SCF fusion protein improves adenoviral vector-mediated gene transfer to c-Kit-positive hematopoietic cells. J Gene Med. 2003 Nov;5(11):929-40.
10.Flickinger Jr, J.C., et al., Chimeric Ad5.F35 vector evades anti-adenovirus serotype 5 neutralization opposing GUCY2C-targeted antitumor immunity. Journal for ImmunoTherapy of Cancer, 2020. 8(2).
