沈陽藥科大學孫進、何仲貴與新加坡國立大學陳小元、倪倩倩合作在Nature Communications發表文章。作者精心構建了一個能夠預防全身副作用并激活抗腫瘤免疫的細胞因子傳遞平臺。憑借出色的安全性和完善的制造工藝,仿生納米疫苗在改善IL-15向淋巴結的靶向遞送方面展現出巨大的前景。從機制上講,作者已經證明了其以多價方式介導IL-15反式呈遞并激活強大的腫瘤特異性CTL反應。傳統的細胞因子治療常常會因非腫瘤特異性T細胞的全身激活而引起劑量限制性毒性。這種方法可以通過多價IL-15自反式呈遞 (MIST) 和腫瘤抗原呈遞的時空整合誘導更安全、更有效的針對腫瘤的CTL免疫反應,從而徹底改變傳統的細胞因子療法。這種策略增強了腫瘤特異性T細胞反應,顯著增強治療效果,促進腫瘤清除,并提高持久的免疫記憶。鑒于細胞膜囊泡對天然蛋白質插入的耐受性,該策略為細胞因子遞送提供了一種通用的方法。盡管細胞膜囊泡制劑的生產過程有些復雜,但細胞膜囊泡的生產和質量控制并不是主要障礙,因為作者已經為細胞膜囊泡的放大制備制定了標準,并進行了適當的質量控制。

傳統的IL-15治療很可能與淋巴結中數量較多的非腫瘤特異性T細胞結合,導致治療效果不理想且副作用嚴重。相反,biNV-IL-15會靶向腫瘤特異性T細胞,同時遞送多價IL-15和腫瘤抗原,專門刺激腫瘤特異性T細胞激活,提高治療效果并防止副作用。作者探索了biNV-IL-15對初始CD8+ T細胞的啟動效果。收集脾臟CD8+ T細胞并用不同的制劑孵育。從4T1或CT26腫瘤組織中分別提取HCP作為腫瘤抗原制備biNV-IL-15,并通過多步密度梯度超速離心從未經處理的BMDC制備DC囊泡。biNV可以刺激CD8+ T細胞產生更高水平的IFN-γ和TNF-α,導致T細胞介導的針對4T1和CT26腫瘤細胞的溶解效率更高。

圖1. 仿生疫苗介導IL-15自呈遞
IL-15的體內反式呈遞依賴于其有效遞送至淋巴器官。然而,快速的全身清除和次級淋巴器官保留不足仍然是IL-15臨床應用的主要障礙。在該研究中,作者用Cy-7標記IL-15和biNV-IL-15,并研究了它們靜脈給藥后的藥代動力學和生物分布特性。IL-15-Cy7迅速從血液循環中消除,半衰期(t1/2)為0.69小時。令人鼓舞的是,biNV-IL-15-Cy7顯示出較長的循環時間,t1/2約為5.66小時。與游離IL-15-Cy7相比,biNV-IL-15-Cy7的AUC升高約 6.6 倍。biNV-IL-15-Cy7在腋窩和腹股溝淋巴結表現出比IL-15-Cy7高12.3倍和15.3倍的藥物積累。
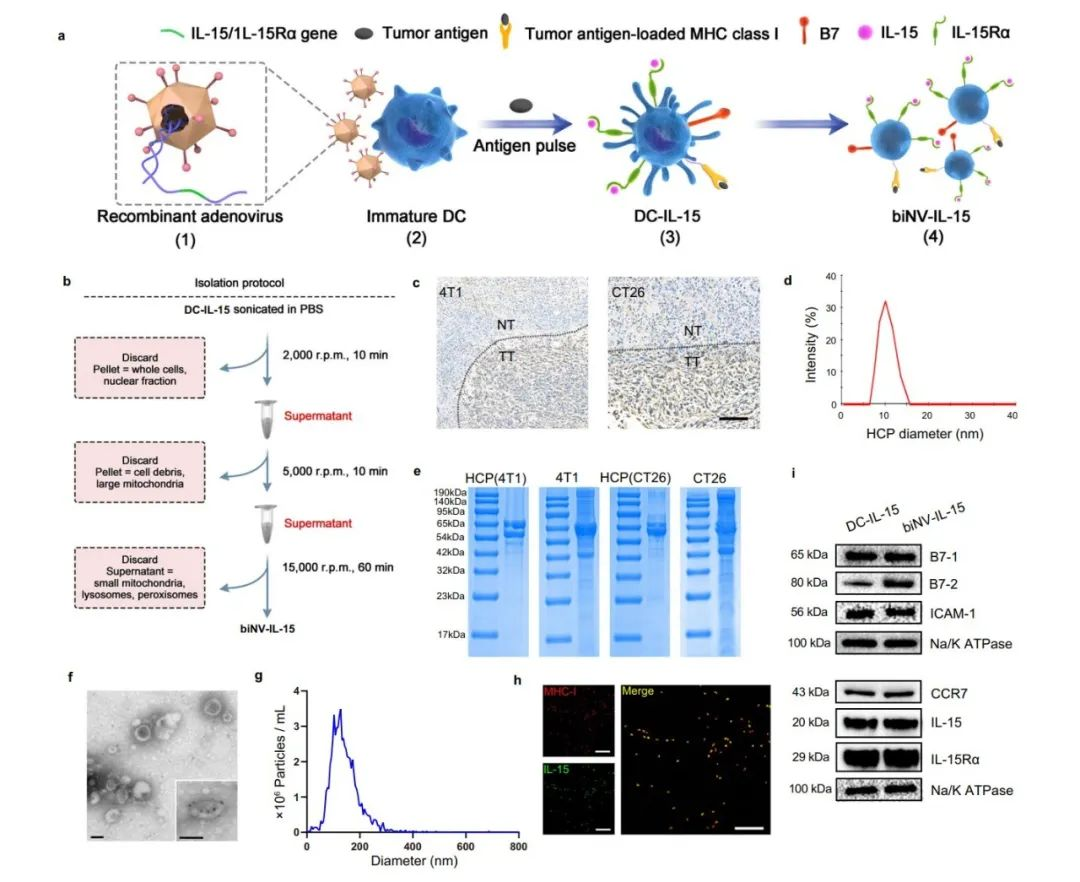
圖2. biNV-IL-15合成
接下來,作者研究了biNV-IL-15的體內毒性。健康小鼠按照梯度給藥方案接受 IL-15 和 biNV-IL-15 治療。四次注射 IL-15(單次治療劑量超過7.5 μg)后觀察到體重顯著下降,最終導致致命的免疫毒性。相比之下,即使在最大可用注射劑量(相當于10 μg IL-15)下,biNV-IL-15的治療也沒有出現明顯的毒性。此外,作者測試了用不同制劑治療的小鼠的血清生化參數和血液學參數,多價IL-15自反式呈遞在可達到的最大劑量下仍能保持生物標志物的基礎水平。
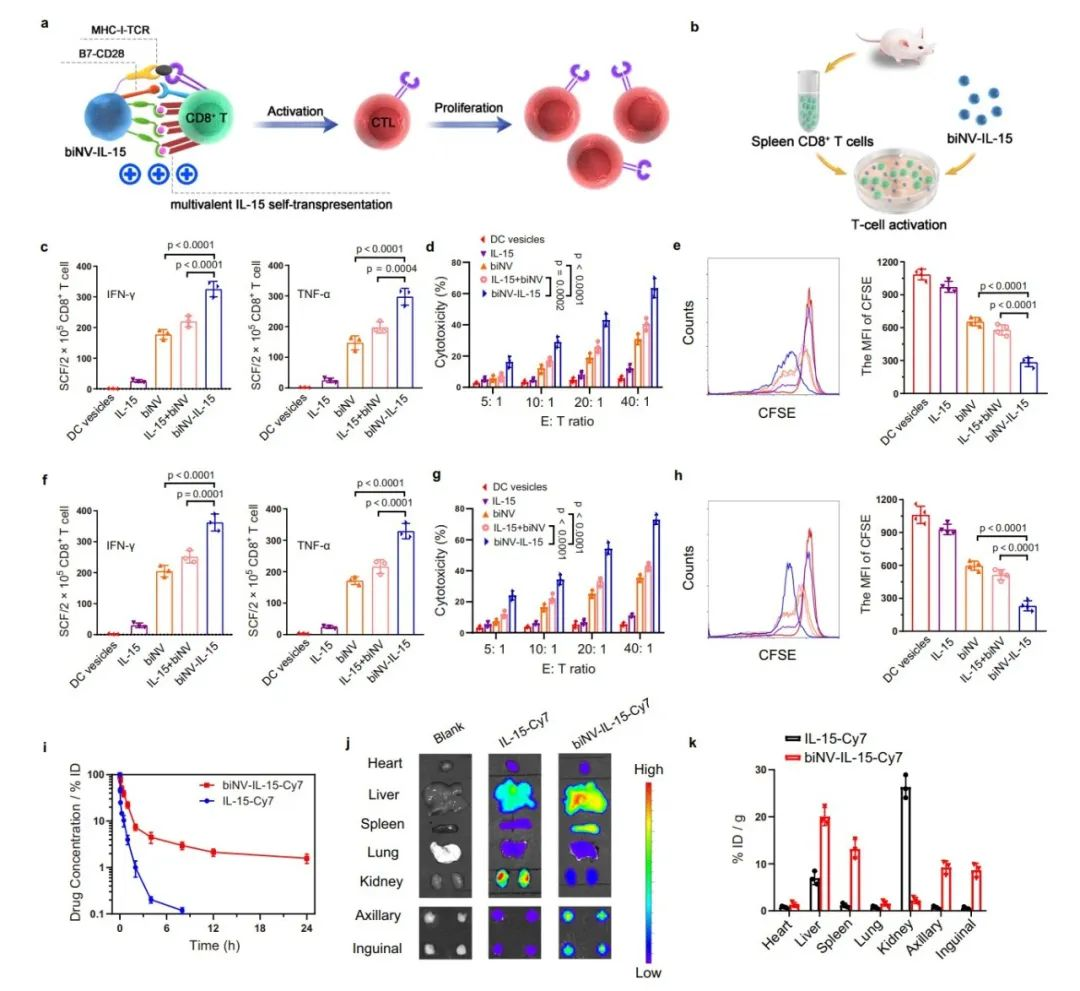
圖3. IL-15的自呈遞
作者進一步研究了biNV-IL-15在不同腫瘤模型中的抗腫瘤活性。PBS和DC囊泡治療均未表現出抗腫瘤作用,IL-15略微延遲了腫瘤生長。而biNV表現出改善的腫瘤抑制功效和延長的生存期,表明仿生納米疫苗介導的腫瘤抗原呈遞具有潛在的治療作用。與IL-15+biNV相比,biNV-IL-15表現出顯著增強的抗腫瘤活性并延長了生存期。
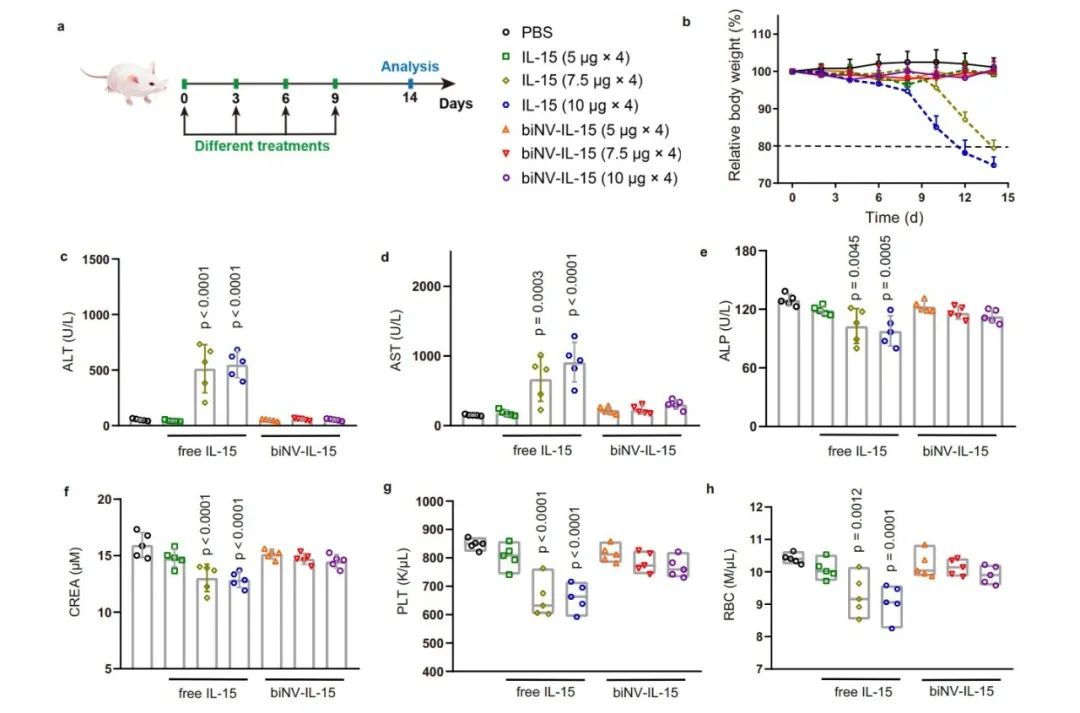
圖4. 提升的IL-15治療窗
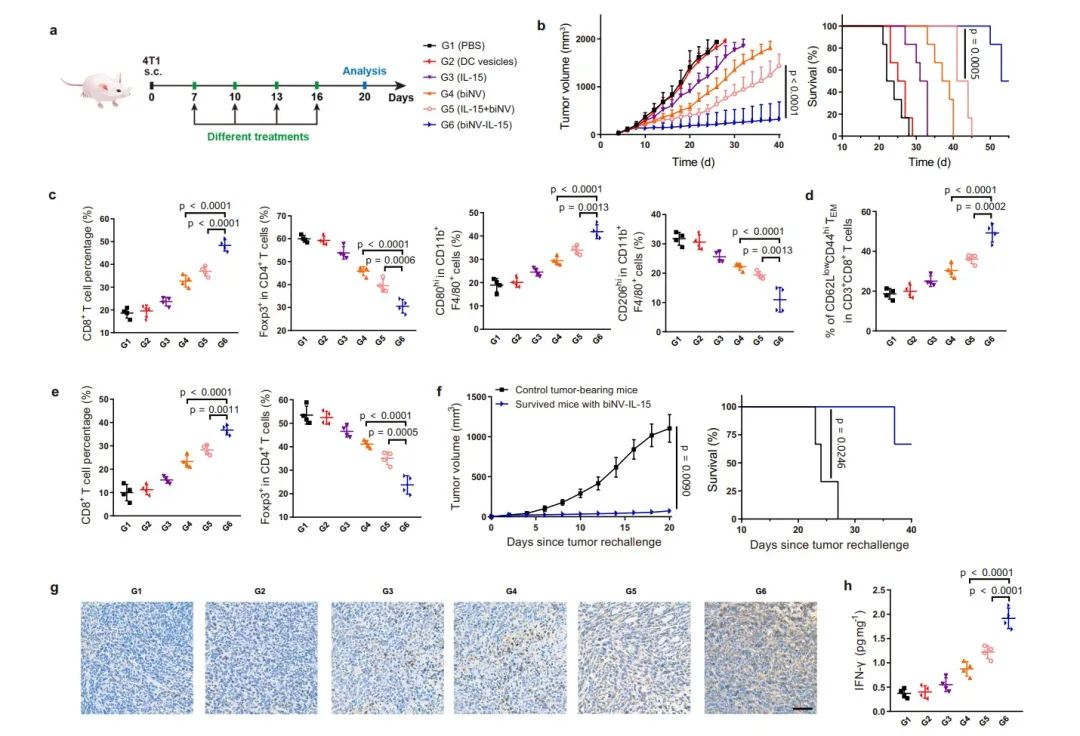
圖5. 體內抗腫瘤療效
吉凱助力:
本文IL-15和IL-15Rα編碼的重組腺病毒由吉凱基因提供,助力高水平的科學研究。
作者簡介:
沈陽藥科大學孫進、何仲貴與新加坡國立大學陳小元、倪倩倩是本文的通訊作者。
