目前研究大腦發(fā)育和疾病使用最廣泛的小鼠模型與人腦之間存在著大小、結(jié)構(gòu)、細(xì)胞間相互作用等諸多方面的差異。而人腦類器官源自人體自組織,可以忠實(shí)地模擬人腦的結(jié)構(gòu)與功能。自2013年Madeline A Lancaster等首次開發(fā)至今[1],其已成為可系統(tǒng)性概述大腦皮層不同區(qū)域,包括海馬體、中腦、丘腦、下丘腦、小腦等的發(fā)育特征的重點(diǎn)模型。
在相關(guān)研究如火如荼的當(dāng)下,2024年12月12日,美國(guó)南加州大學(xué)洛杉磯分校和英國(guó)劍橋大學(xué)的研究團(tuán)隊(duì)聯(lián)合在Nature子刊Nature reviews. Molecular cell biology發(fā)表了題為“Modelling human brain development and disease with organoids”的重磅綜述,對(duì)腦類器官的研究現(xiàn)狀和應(yīng)用場(chǎng)景進(jìn)行了系統(tǒng)性闡釋。作者首先回顧了多種優(yōu)化人腦類器官生理相關(guān)性的方式,同時(shí)匯總了腦類器官應(yīng)用場(chǎng)景及研究進(jìn)展。最后,作者還對(duì)腦類器官面臨的社會(huì)倫理問題進(jìn)行了提醒,并點(diǎn)明了眼下研究的困局,指明了未來的重點(diǎn)發(fā)展方向。

(來源:參考資料[2])
01 腦類器官的建立與優(yōu)化
胎兒腦干細(xì)胞、皮質(zhì)組織干細(xì)胞和組織干細(xì)胞(hPSCs)來源的腦類器官培養(yǎng)方法均已建立。從各種方式獲得的干細(xì)胞在體外首先形成3D的擬胚體(EB),而后進(jìn)行2-5天的神經(jīng)誘導(dǎo),從外胚層形成神經(jīng)板,神經(jīng)板閉合形成神經(jīng)管。接下來,神經(jīng)管內(nèi)壁的神經(jīng)上皮干細(xì)胞向不同的神經(jīng)細(xì)胞命運(yùn)分化。與此同時(shí),神經(jīng)管發(fā)育為前腦、中腦以及后腦三個(gè)初級(jí)腦泡。前腦進(jìn)一步發(fā)育為端腦和間腦,其中端腦發(fā)育為大腦皮層,而間腦發(fā)育為丘腦、下丘腦、視網(wǎng)膜等其他區(qū)域。
已有大量研究鑒別了大腦發(fā)育過程中多個(gè)關(guān)鍵信號(hào)通路。相應(yīng)地,需要在腦類器官培養(yǎng)的不同階段合理地添加或抑制相關(guān)生長(zhǎng)因子進(jìn)行調(diào)控。堿性成纖維細(xì)胞生長(zhǎng)因子(bFGF)在最初干細(xì)胞分化為擬胚體的過程中添加,以刺激神經(jīng)發(fā)生和膠質(zhì)細(xì)胞生成。此外,在類器官生成的早期階段抑制WNT信號(hào)有助于抑制中胚層譜系,并加強(qiáng)向強(qiáng)皮質(zhì)身份的分化。
由于缺乏真正的信號(hào)生發(fā)中心,現(xiàn)如今的腦類器官培養(yǎng)中,不同細(xì)胞的分化命運(yùn)依賴于形態(tài)發(fā)生素的濃度梯度。SHH作為一種形態(tài)發(fā)生素,其信號(hào)強(qiáng)度可決定神經(jīng)管腹側(cè)細(xì)胞的分化命運(yùn)。高濃度的SHH誘導(dǎo)腹部神經(jīng)元的形成,而低濃度的SHH則誘導(dǎo)運(yùn)動(dòng)神經(jīng)元等的形成。骨形態(tài)發(fā)生蛋白(BMP)也是形態(tài)發(fā)生素的一種,其參與調(diào)控神經(jīng)誘導(dǎo)到分化的整個(gè)階段,可促進(jìn)背部神經(jīng)細(xì)胞的命運(yùn),調(diào)節(jié)神經(jīng)嵴的形成,并影響膠質(zhì)細(xì)胞的生成和神經(jīng)元亞型的特化。腦源性生長(zhǎng)因子(BDNF)、神經(jīng)營(yíng)養(yǎng)因子-3(NT-3)、膠質(zhì)細(xì)胞源性神經(jīng)營(yíng)養(yǎng)因子(GDNF)等也參與神經(jīng)元的分化和成熟,尤其是多巴胺能和GABA能突出的正常生長(zhǎng)。
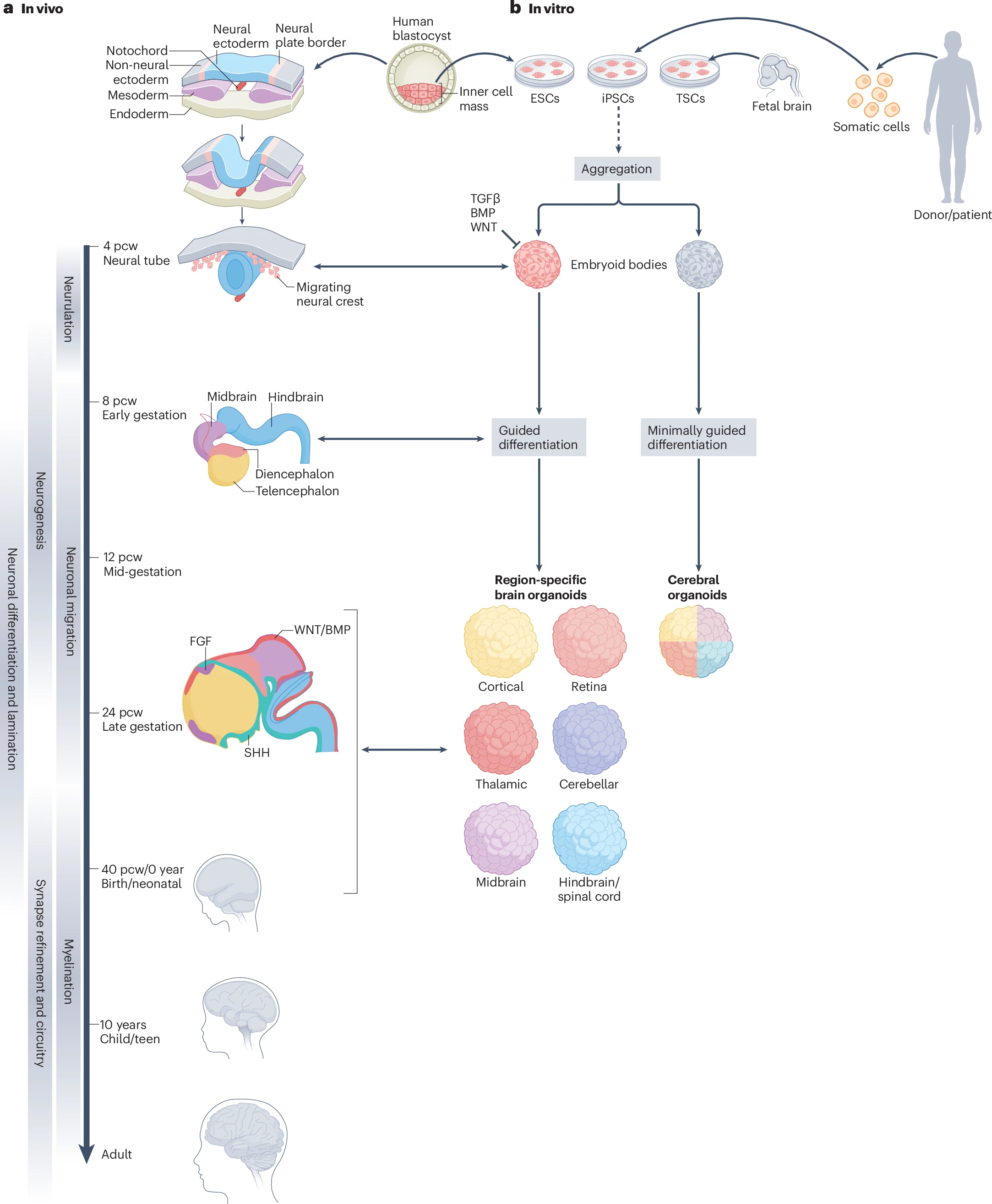
圖1:模擬腦發(fā)育,建立腦類器官
(來源:參考資料[2])
本綜述中,作者著重提出,為了創(chuàng)建復(fù)雜神經(jīng)發(fā)育過程的精確模型,還需要對(duì)細(xì)胞多樣性、結(jié)構(gòu)復(fù)雜性和成熟過程進(jìn)行多重優(yōu)化,以提高人腦類器官的生理相關(guān)性。
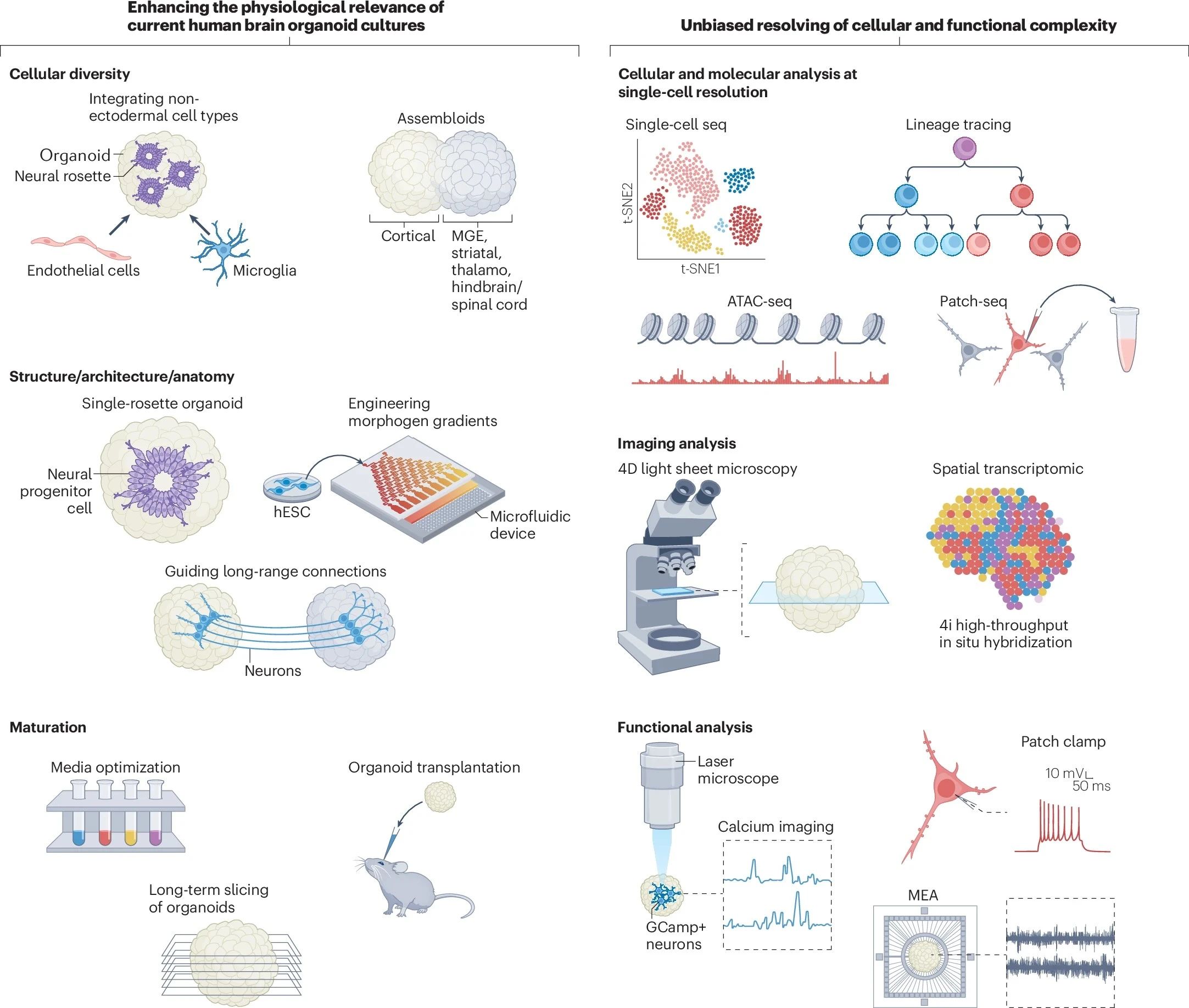
圖2:腦類器官的優(yōu)化路線
(來源:參考資料[2])
增加細(xì)胞多樣性
除神經(jīng)元外,膠質(zhì)細(xì)胞如星形膠質(zhì)細(xì)胞和少突膠質(zhì)細(xì)胞等在大腦發(fā)育中起到結(jié)構(gòu)支持、營(yíng)養(yǎng)等重要作用。澳大利亞和韓國(guó)科學(xué)家們已經(jīng)通過添加肝細(xì)胞生長(zhǎng)因子(HGF)、胰島素生長(zhǎng)因子(IGF)等,成功將培養(yǎng)出成熟少突膠質(zhì)細(xì)胞的時(shí)間從原本的100天以上縮減到約40天(圖3)[3]。

圖3:短期誘導(dǎo)成熟少突膠質(zhì)細(xì)胞生成的方法
(來源:參考資料[3])
此外,非外胚層細(xì)胞,如來自于中胚層的小膠質(zhì)細(xì)胞也對(duì)捕獲腦發(fā)育和病理學(xué)復(fù)雜性至關(guān)重要,而神經(jīng)血管網(wǎng)絡(luò)也是準(zhǔn)確模擬大腦后期發(fā)育所不可或缺的。研究表明,用血管內(nèi)皮生長(zhǎng)因子(VEFG)和生長(zhǎng)因子WNT7B共處理腦類器官,并將內(nèi)皮細(xì)胞與腦類器官共培養(yǎng)可誘導(dǎo)血管化。事實(shí)上,已有研究團(tuán)隊(duì)通過將大腦類器官與血管類器官融合,首次構(gòu)建出具有人類血腦屏障全功能的腦類器官,為神經(jīng)系統(tǒng)疾病機(jī)理研究及藥物提供了更為可靠的平臺(tái)(圖4)[4]。
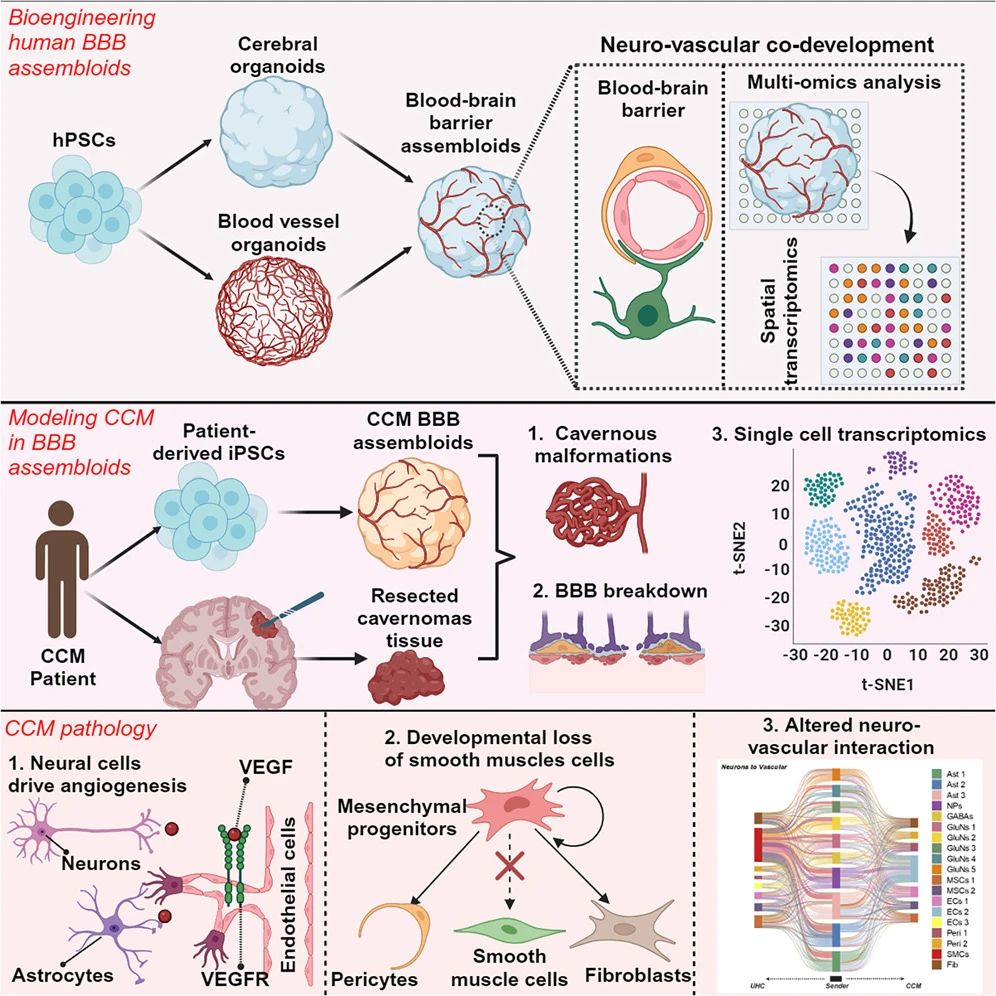
圖4:生成具有人類血腦屏障全功能腦類器官的路徑
(來源:參考資料[4])
另外,共培養(yǎng)向不同腦命運(yùn)分化的單個(gè)類器官,也可模擬神經(jīng)系統(tǒng)和不同區(qū)域神經(jīng)元之間功能鏈接的形成。定義涵蓋有皮質(zhì)、內(nèi)側(cè)神經(jīng)節(jié)隆起(MGE)、丘腦、后腦/脊髓等多個(gè)區(qū)域特異性類器官的融合體為類組裝體(assembloids)。此舉可增強(qiáng)多樣性以研究細(xì)胞遷移、整合和突觸形成。
提升結(jié)構(gòu)相似性
為了獲得更接近生理大腦的結(jié)構(gòu),首先需要工程化的水凝膠、微纖維支架等多種結(jié)構(gòu)支撐技術(shù)。
另外,如前文所述,形態(tài)發(fā)生素濃度梯度對(duì)于神經(jīng)元祖細(xì)胞位置和身份的發(fā)也至關(guān)重要。為此,可以使用合成生物學(xué)方法,工程化誘導(dǎo)形態(tài)發(fā)生素SHH的釋放,激活背腹和前后位置軸上有序的自組織以形成模式化的前腦亞區(qū)。區(qū)別于前文所述“單個(gè)類器官共培養(yǎng)”方案,這相當(dāng)于從另一條“一鏡到底”的通路,由形態(tài)發(fā)生素濃度梯度直接誘導(dǎo)了不同的腦區(qū)分化,并最終形成整合了不同區(qū)域特異性的“類組裝體”。其后FGF-8的添加可進(jìn)一步協(xié)助產(chǎn)生軸向模式化的皮層類器官以探索更復(fù)雜的表型。
另一方面,微流控裝置也可輔助精準(zhǔn)控制形態(tài)發(fā)生素的遞送。已經(jīng)通過微流控驗(yàn)證發(fā)現(xiàn),視磺酸和SMO激動(dòng)劑的正交梯度可模擬形態(tài)發(fā)生素對(duì)運(yùn)動(dòng)神經(jīng)元分化的組合作用。使用微流控,還可在hPSC分化期間產(chǎn)生WNT梯度以模擬神經(jīng)管的發(fā)育(圖5)[5],該方法也被稱為“微流控控制的干細(xì)胞區(qū)域化”(MiSTR)。總之,微流控具有外部調(diào)控形態(tài)發(fā)生素的時(shí)空梯度以控制PSC自組織模塊化的能力。
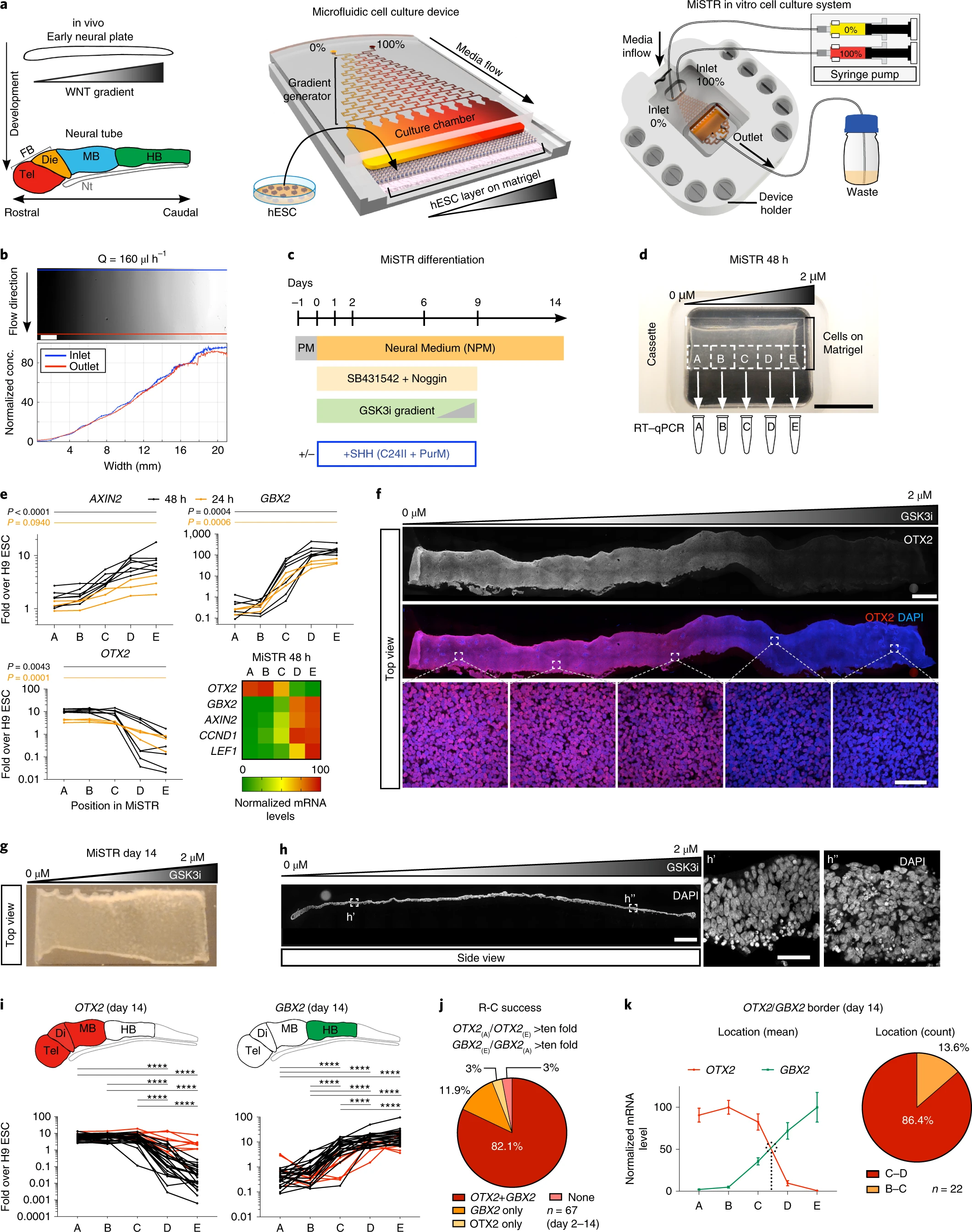
圖5:MiSTR細(xì)胞培養(yǎng)系統(tǒng)的設(shè)計(jì)和hESC衍生組織中WNT信號(hào)傳導(dǎo)梯度的建立
(來源:參考資料[5])
促進(jìn)成熟與功能化
其后,作者回顧了促進(jìn)類器官成熟和功能性的手段,再次肯定了微流控系統(tǒng)對(duì)于控制不同腦區(qū)之間遠(yuǎn)程信息溝通、模擬體內(nèi)腦回路方面的重要意義。此外,切片培養(yǎng)和氣-液界面培養(yǎng)也可改善腦類器官的氧供應(yīng)并減少細(xì)胞死亡(圖6)[6]。
小分子混合物如GENtoniK等可促進(jìn)腦類器官成熟,也可考慮引入模型的構(gòu)建。異種移植也是增強(qiáng)hPSC衍生的神經(jīng)元的結(jié)構(gòu)和功能特征的重要策略。對(duì)移植類器官的分析已經(jīng)揭示了進(jìn)行性神經(jīng)元分化和成熟、膠質(zhì)生成、宿主小膠質(zhì)細(xì)胞的整合、脈管系統(tǒng)的侵襲以及與宿主大腦形成功能連接的軸突的建立。
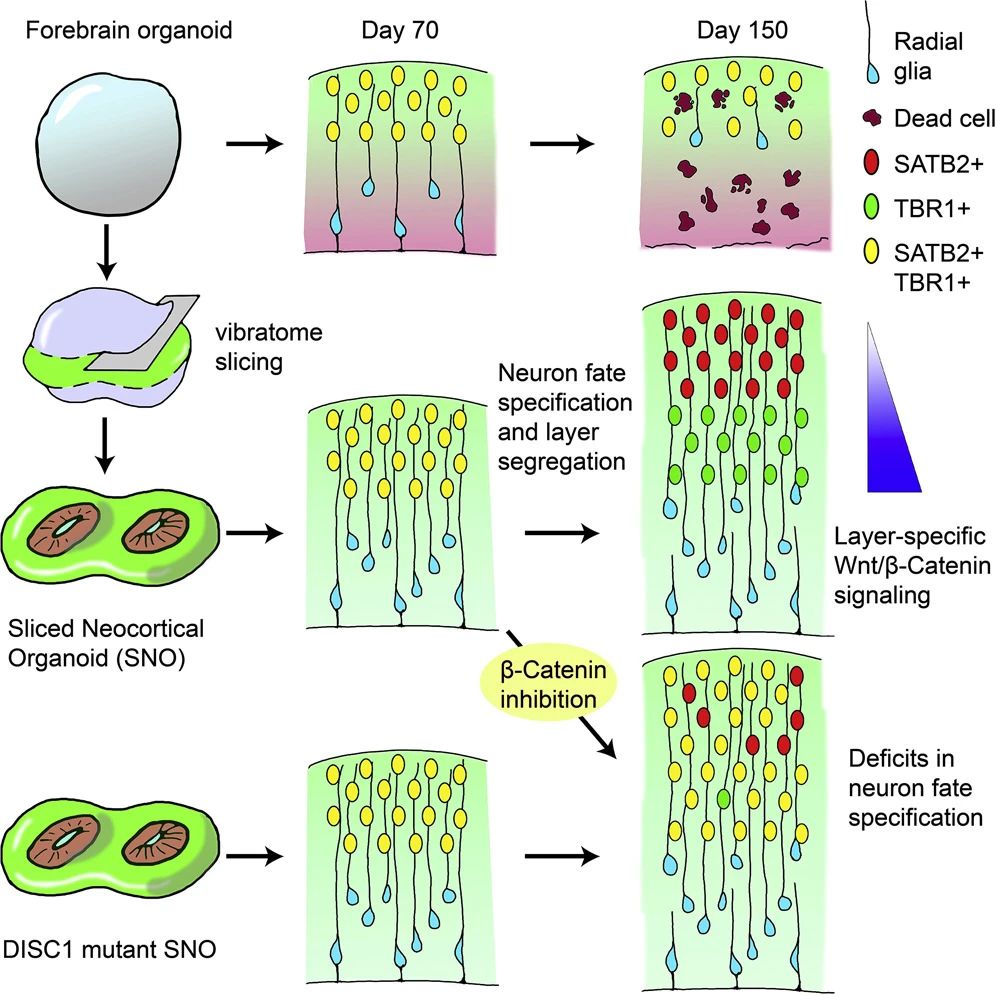
圖6:新皮質(zhì)類器官切片克服內(nèi)部缺氧難題并減少細(xì)胞死亡
(來源:參考資料[6])
02 腦類器官的應(yīng)用
腦類器官的主要應(yīng)用在于模擬多種腦部疾病以提供機(jī)理探索、毒性測(cè)試和藥物篩選的體外平臺(tái)。在此,作者首先概括了多種使用腦類器官模型獲得重大突破的病癥實(shí)例。
譬如,無腦回畸形綜合征(MDS)屬于嚴(yán)重的皮質(zhì)畸形。來自MDS患者的腦類器官研究提示,N-鈣粘蛋白-β-catenin/WNT信號(hào)通路的破壞可能是主要病因之一。而在神經(jīng)發(fā)育障礙中,患者來源的皮質(zhì)類器官已用于輔助具有強(qiáng)烈臨床異質(zhì)性的特發(fā)性孤獨(dú)癥譜系障礙(ASD)的病因探索,并挖掘出了包括FOXG1在內(nèi)多個(gè)差異性表達(dá)的發(fā)病關(guān)鍵基因。在神經(jīng)精神疾病方面,也有報(bào)道利用來自雙相情感障礙患者的腦類器官揭示了疾病相關(guān)的各種分子、細(xì)胞和功能表型特征。在傳染病領(lǐng)域,腦類器官也已用于SARS-CoV-2、HIV等病毒感染模式的研究,并為確定放射狀膠質(zhì)祖細(xì)胞的耗竭為寨卡病毒感染引起的獲得性小頭畸形主要病因做出了貢獻(xiàn)。
![]()
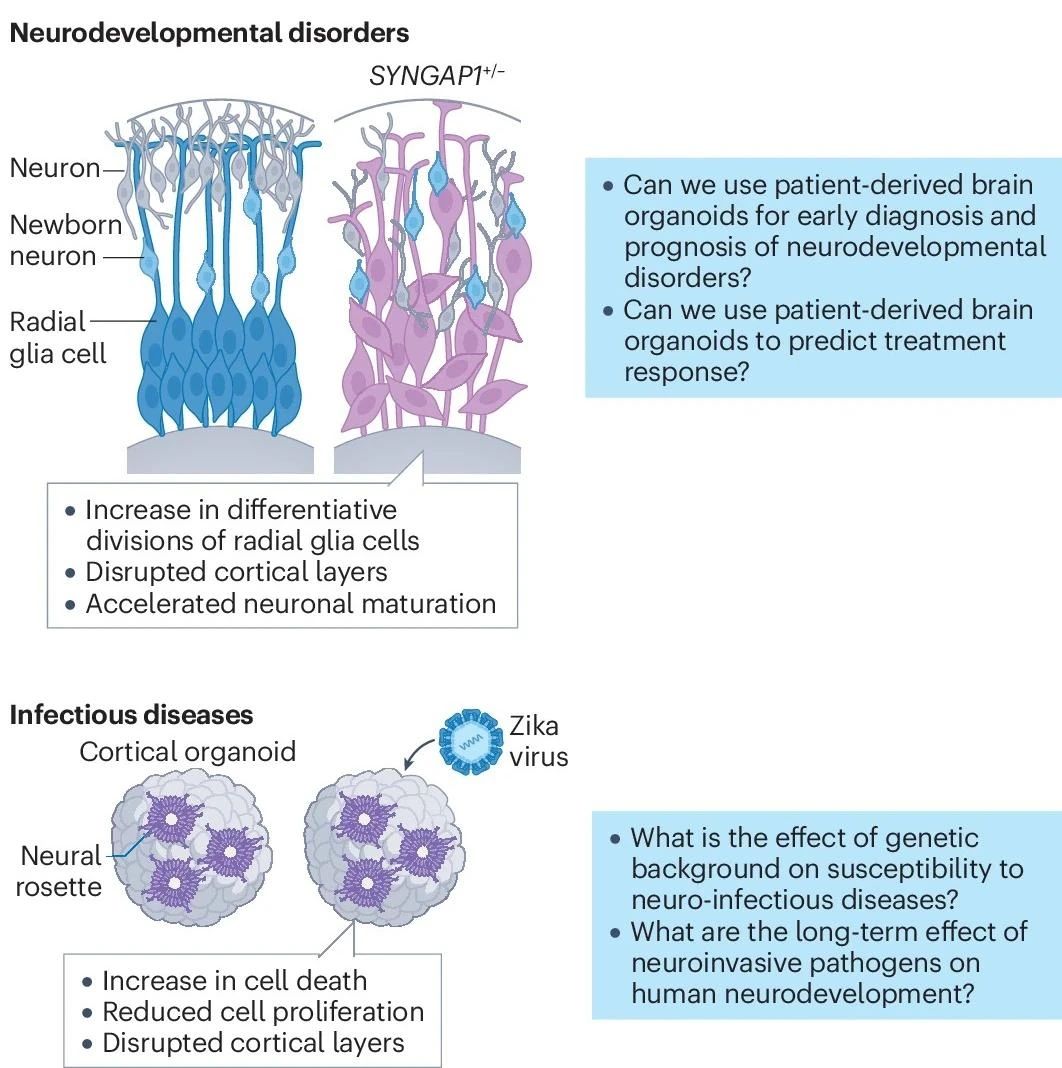
圖7:腦類器官用以疾病探索
(來源:參考資料[2])
除疾病診療外,腦類器官還可參與進(jìn)化多樣性的探討。通過對(duì)比非人靈長(zhǎng)類和人腦類器官,已經(jīng)進(jìn)行了從大腦層面到信號(hào)通路與基因?qū)用娌煌叨壬系牟町惢芯浚f(xié)助人類大腦發(fā)育獨(dú)特特征的解析。
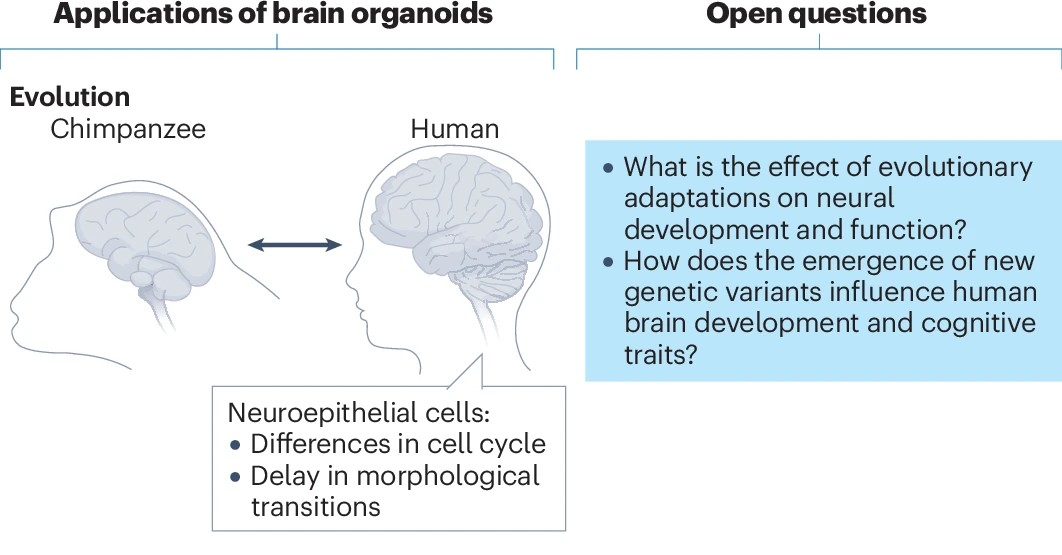
圖8:腦類器官探究大腦進(jìn)化
(來源:參考資料[2])
03 社會(huì)倫理
盡管目前腦類器官的開發(fā)已經(jīng)取得了巨大成功,然而作者提醒,在道德倫理層面還需保持更為審慎的態(tài)度。
首先,干細(xì)胞的獲取必須獲得捐贈(zèng)者的書面同意。中國(guó)科學(xué)院動(dòng)物研究所彭耀進(jìn)等的論文也提到,需要確保捐贈(zèng)者完整明確地知曉生物樣本地使用方式與方法,且理解正確全面,并擁有全部的自主決定權(quán)[7]。
針對(duì)腦類器官,尤其需要嚴(yán)謹(jǐn)定義腦類器官中的意識(shí)狀態(tài)。僅就目前而言,腦類器官尚未企及人腦復(fù)雜程度,并不具備真正的意志認(rèn)知,因此在科學(xué)傳播的過程中應(yīng)當(dāng)格外注意遣詞造句,避免以“小型化的人類大腦”等詞誤導(dǎo)業(yè)界和公眾。且隨著腦類器官的研究發(fā)展,需要從倫理和法律的角度全面地審視其未來可能呈現(xiàn)的人類特征。
此外,腦類器官的來源樣本庫(kù)當(dāng)下嚴(yán)重缺乏多樣性。作者提到,hPSC庫(kù)主要由具有歐洲血統(tǒng)的供體組成。且由于長(zhǎng)時(shí)間培養(yǎng)下X染色體容易失活的影響,干細(xì)胞的選取也偏向于男性來源的樣本。作者強(qiáng)調(diào),確保腦類器官來源的人種、地域、語(yǔ)言、文化、性別等多樣性,對(duì)人類健康的全面理解和探索疾病的異質(zhì)性至關(guān)重要。未來仍需加強(qiáng)在此方面的努力,確保通過腦類器官模型獲取的療法可公平平等地惠及所有人群。
04 總結(jié)與展望
本文提供了腦類器官?gòu)募夹g(shù)到應(yīng)用全生態(tài)全景路線圖,為渴望了解深入腦類器官領(lǐng)域的研究者提供了重要指南。
展望未來,作者強(qiáng)調(diào),對(duì)于腦類器官技術(shù)上的改進(jìn),或集中在通過應(yīng)用各種生物工程方法促進(jìn)神經(jīng)元的成熟,強(qiáng)化腦區(qū)之間的鏈接、以及功能性腦回路的形成上。此外,作者還樂觀估計(jì),未來幾年,關(guān)于腦類器官與其他身體區(qū)域的類器官之間復(fù)雜相互作用的研究或?qū)涫懿毮?/strong>,以期解碼器官在健康和疾病狀態(tài)下的相互影響。
近岸蛋白具備多種經(jīng)類器官培養(yǎng)驗(yàn)證的細(xì)胞因子,讓您的類器官培養(yǎng)更可控!
參考資料
1. Lancaster, Madeline A et al. “Cerebral organoids model human brain development and microcephaly.”Naturevol. 501,7467 (2013): 373-9. doi:10.1038/nature12517
2. Birtele, Marcella et al. “Modelling human brain development and disease with organoids.” Nature reviews. Molecular cell biology, 10.1038/s41580-024-00804-1. 12 Dec. 2024, doi:10.1038/s41580-024-00804-1
3. Shaker, Mohammed R et al. “Rapid and Efficient Generation of Myelinating Human Oligodendrocytes in Organoids.” Frontiers in cellular neuroscience vol. 15 631548. 17 Mar. 2021, doi:10.3389/fncel.2021.631548
4. Dao, Lan et al. “Modeling blood-brain barrier formation and cerebral cavernous malformations in human PSC-derived organoids.” Cell stem cell vol. 31,6 (2024): 818-833.e11. doi:10.1016/j.stem.2024.04.019
5.Rifes, Pedro et al. “Modeling neural tube development by differentiation of human embryonic stem cells in a microfluidic WNT gradient.” Nature biotechnology vol. 38,11 (2020): 1265-1273. doi:10.1038/s41587-020-0525-0
6.Qian, Xuyu et al. “Sliced Human Cortical Organoids for Modeling Distinct Cortical Layer Formation.” Cell stem cell vol. 26,5 (2020): 766-781.e9. doi:10.1016/j.stem.2020.02.002
7.陳倩文, 趙思琪, 彭耀進(jìn). 類器官:技術(shù)創(chuàng)新與倫理爭(zhēng)議[J]. 合成生物學(xué), 2024, 5(4): 898-907
