胃腸道內分泌細胞(EECs)通過受體傳感器釋放各種肽類激素,以靶向調控食物消化、營養同化、胰島素釋放等過程。EECs共有10多種亞型(圖1),其功能障礙與多種疾病病因緊密關聯,如胰高血糖素樣肽-1(GLP-1)分泌受阻與糖尿病和肥胖的高發生相關。因此,EECs已成為代謝疾病的重要治療靶點,亟需更健全的數據庫及更深入的研究。
事實上,人體內EECs數量極其稀少,僅占腸上皮的約1%,且組織來源的EECs在未經固定的情況下難以識別并純化,而小鼠等模式動物與人類之間又存在顯著的種間差異。相較而言,來自于人原代組織,保留器官生理功能并具備結構相似性的類器官正在成為研究EECs功能的體外重點模型。
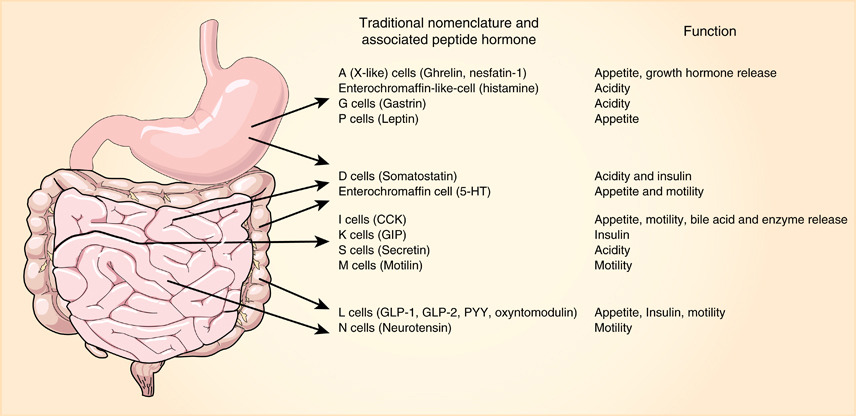
圖1:胃腸道內分泌細胞的不同亞型
(來源:參考資料[1])
2020年,類器官之父Hans Clevers團隊開發出腸道內分泌細胞的類器官平臺,并據此繪制了EECs的轉錄組學與分泌產物表達圖譜,為體外EECs功能的研究奠定了基礎[2]。2024年10月23日,Hans Clevers教授再次聯合羅氏制藥團隊,于頂刊Science發表了題為“Description and functional validation of human enteroendocrine cell sensors”的研究論文。本研究中,通過NEUROG3過表達誘導了胃類器官EECs文庫的生成,并結合此前的腸道類器官EECs文庫生成了深度受體轉錄組圖譜。該類器官數據庫與CD200篩選得到的組織EECs具有高度一致性,可作為體外可靠模型。研究團隊隨后在具有22個不同受體缺陷的類器官系中進行了配體誘導的分泌實驗,揭示了調控GLP-1等激素分泌的多個受體傳感器,為糖尿病等治療提供了潛在的藥理學靶點。

(來源:參考資料[3])
01 誘導胃類器官向內分泌譜系分化
長久以來,EECs一直難以在胃類器官中大量產生。在此,研究人員向其培養基中加入多西環素,誘導胃類器官過表達NEUROG3(一類在EECs祖細胞中共同表達的轉錄因子)兩天,隨后將類器官轉移至含有EGF、Noggin和R-spondin的培養基中成熟。透射電子顯微鏡結果顯示,類器官成功分化產生了EECs。
這些EECs可在 cAMP激動劑刺激下產生5-羥色胺(5-HT)和生長素釋放肽,顯示出成熟的分泌功能。蛋白質組學分析發現,僅在NEUROG3過表達的情況下,胃類器官產生積蓄于胞內以及運送出胞外的內分泌產物,且檢出多種已知的全長并具有生物活性胃內分泌激素。在沒有NEUROG3過表達的對照組中,胃類器官細胞傾向于構建黏液屏障執行保護胃腸道黏膜的正常生理功能,而非內分泌功能。
此外,加入類器官生長因子BMP還可誘導細胞胃動素MLN、神經肽NPW等激素的表達。而激素肽TAC3等僅在沒有添加BMP的情況下富集。但不論BMP添加與否,ECL(腸嗜鉻樣細胞,胃體獨特的EEC亞群)標志物均未檢出。
總而言之,NEUROG3足以誘導除ECL外主要胃內分泌譜系的分化。BMP可在此基礎上對分泌產物進行調控和修飾。
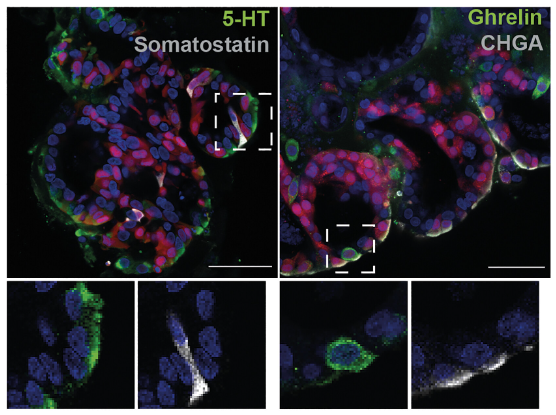
圖2:富含EECs的類器官的免疫熒光染色
(來源:參考資料[3])
02 胃腸類器官EECs中的GPCR譜
與此前建立的腸道類器官文庫結合,研究人員從胃腸道類器官整體文庫中篩選得到EECs,bulk RNA-seq分析發現其激素表達譜與預期一致。
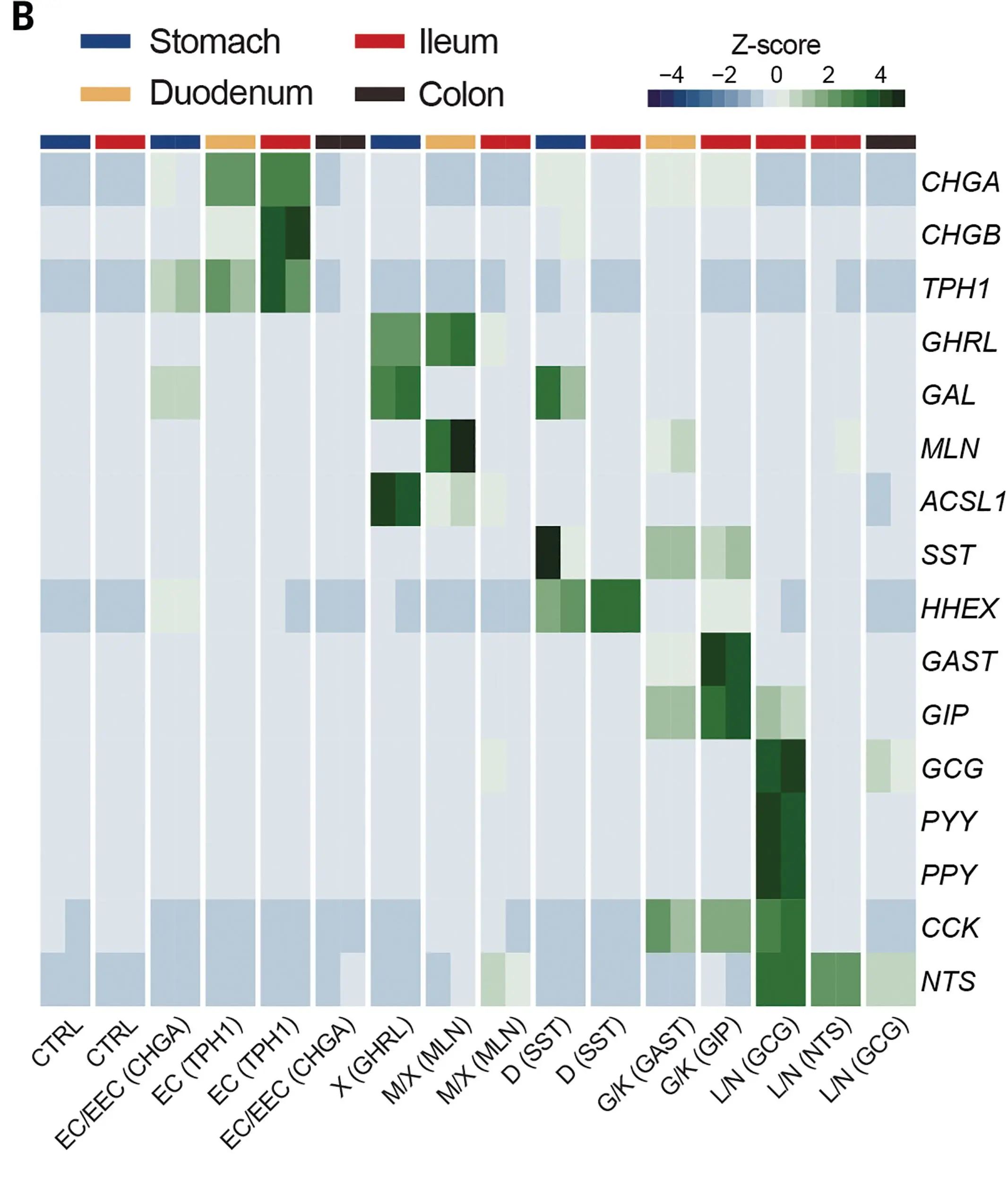
圖3:EECs中激素表達譜熱圖
(來源:參考資料[3])
G蛋白偶聯受體(GPCR)可通過與配體的結合響應胃腸道環境變化,進而調控EECs內的鈣離子水平并控制激素分泌,是一類非常重要和典型的激素傳感器。研究人員隨后聚焦于以GPCR為代表的受體,發現在胃腸道類器官EECs中,除許多與此前報道相同的GPCR表達外,還發現了一些此前未知的EECs特異性受體基因,如黑寡婦毒素α-latroxin受體ADGRL1/2、多巴胺受體DRD2等。
有趣的是,研究人員還發現了部分受體的表達譜與此前報道不符,如據稱可調控胰高血糖素樣肽1(GLP-1)的黑皮質素受體MC4R在任何EECs中均無顯著表達,而另一種黑色素皮質素受體MC1R則有少量檢出。此外,小腸EC細胞的5-HT分泌主要通過營養受體膽汁酸受體GPBAR1調節,這也與過往結果有所出入。
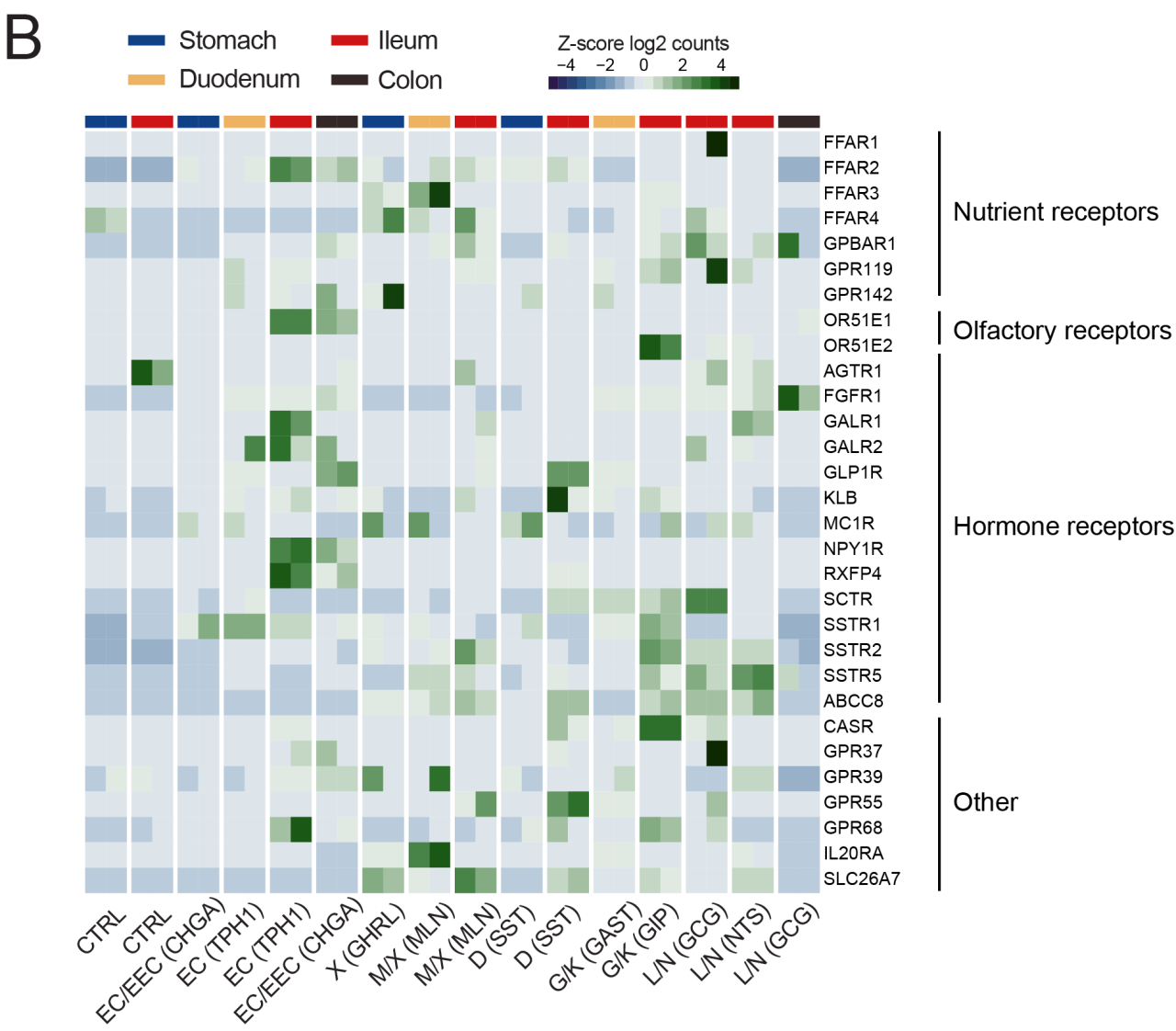
圖4:類器官EECs中受體基因表達譜熱圖
(來源:參考資料[3])
03 類器官EECs與人原代EECs高度一致
研究人員隨后從人胃、小腸和結腸活檢組織中分選富含CD200(一類免疫調節劑,可作為EECs的一般表面標志物)和EPCAM的細胞并進行了scRNA-seq,獲取了比以往更深度的人類EECs數據集。與類器官EECs表達譜一致的是,人類組織EECs中也檢出了富集的α-latroxin受體與少量MC1R,且未檢測到MC4R。
為探究胃類器官因何緣由無法產生ECL細胞,研究者對組織數據集中的ECL分化調節因子進行了研究,發現其中轉錄因子PTF1A及BRPJL和其靶基因LHX5特異性表達水平極高。PTF1A是胰腺發育中負責胰蛋白酶、淀粉酶等多種消化酶分泌的調控因子。在此,PTF1A過表達時,細胞向腺泡轉分化,相應肽酶出現高表達,類器官大量凋亡,基質膠降解。此外,盡管LHX5與NEUROG3可組合可誘導ECL細胞關鍵標志物組氨酸脫羧酶(HDC)的表達,但其提升能力有限,HDC表達量依舊較低。這些結果表明,胃類器官無法通過此通路產生ECL。
總之,類器官與人類組織來源的人原代EECs之間具有高度一致性,并伴隨有細微的表達區域特異性差異,可作為內分泌譜系(除ECL外)的體外可靠模型。
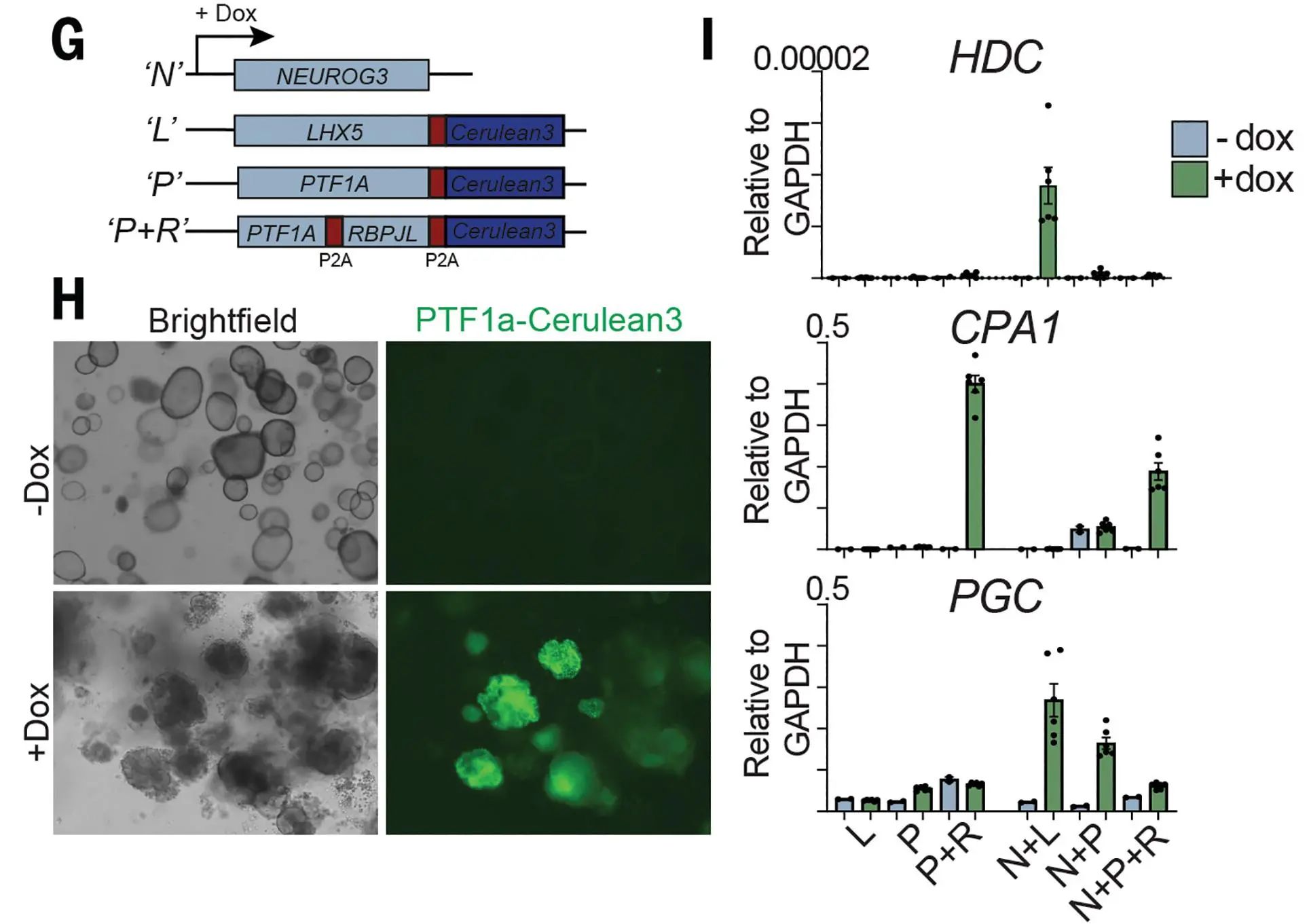
圖5:類器官中LHX5和NEUROG3的組合誘導結果
(來源:參考資料[3])
04 利用類器官EECs進行受體功能研究
在證明類器官EECs可作為體外研究模型后,研究人員引入純合無義突變并構建了22種受體缺陷的胃腸道類器官系。理論上,受體缺陷的類器官,其配體與受體結合并啟動下游激素分泌的通路受阻。若陽性對照組與WT組檢測到激素分泌,則提示該受體是對應激素的調控傳感器。概念驗證證明了膽汁酸受體GPBAR1對GLP-1和5-HT的誘導,這與此前的受體基因表達譜結果一致,也論證了此設計的可行性。
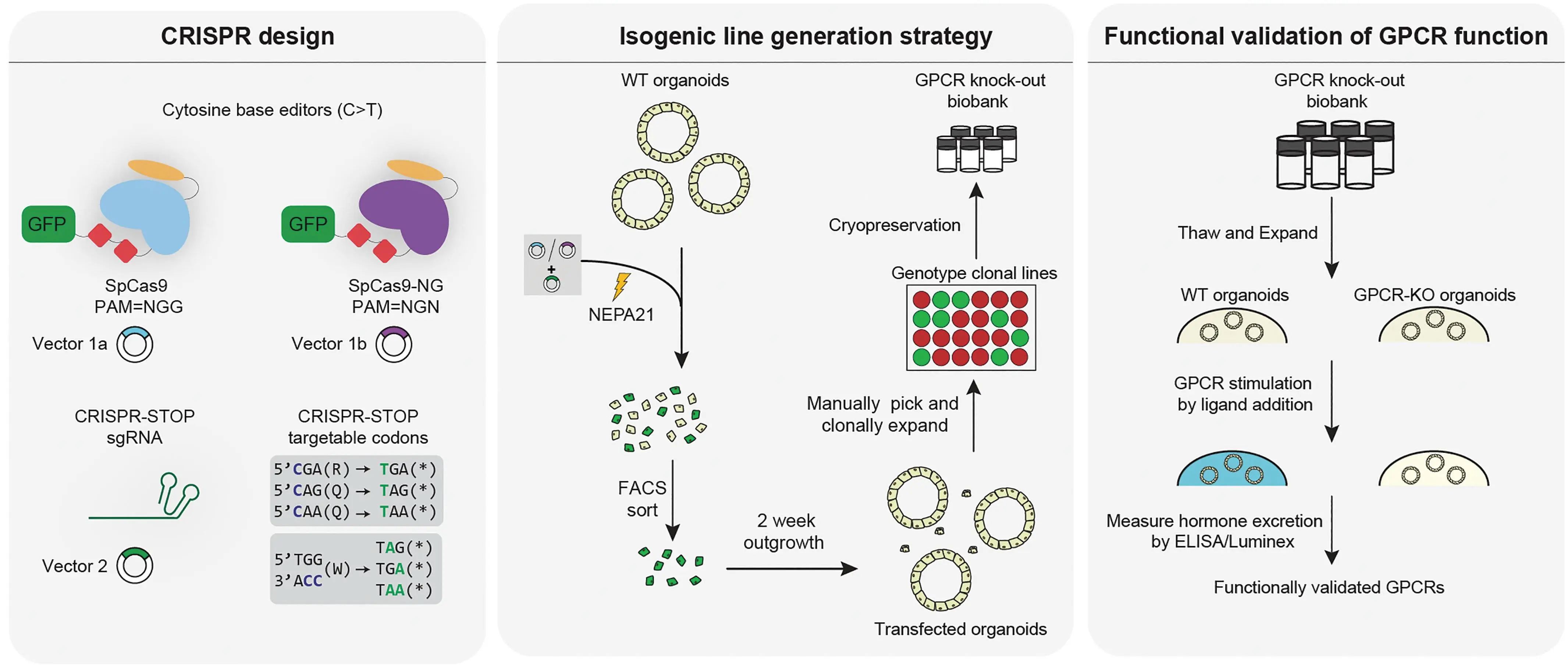
圖6:受體功能研究實驗管線
(來源:參考資料[3])
研究人員進而使用GPCR激動劑刺激了整個類器官文庫,結果發現了所有腸道激素的有效釋放。測試分泌16小時后上清液中激素的濃度,發現抑制磺酰脲受體基因ABCC8可控制ATP敏感性鉀通道并據此調控GLP-1和5-HT的腸道分泌,且ABCC8基因突變與2型糖尿病相關。此外,色氨酸受體CasR也參與控制GLP-1分泌。而大量表達的多巴胺受體可抑制EC(腸嗜鉻細胞,最主要的EEC亞型)中5-HT的分泌。該過程可通過幾種已被批準的多巴胺受體抑制劑逆轉,但不同抑制劑逆轉效果各異,反映了不同多巴胺受體對5-HT分泌的不同抑制活性。
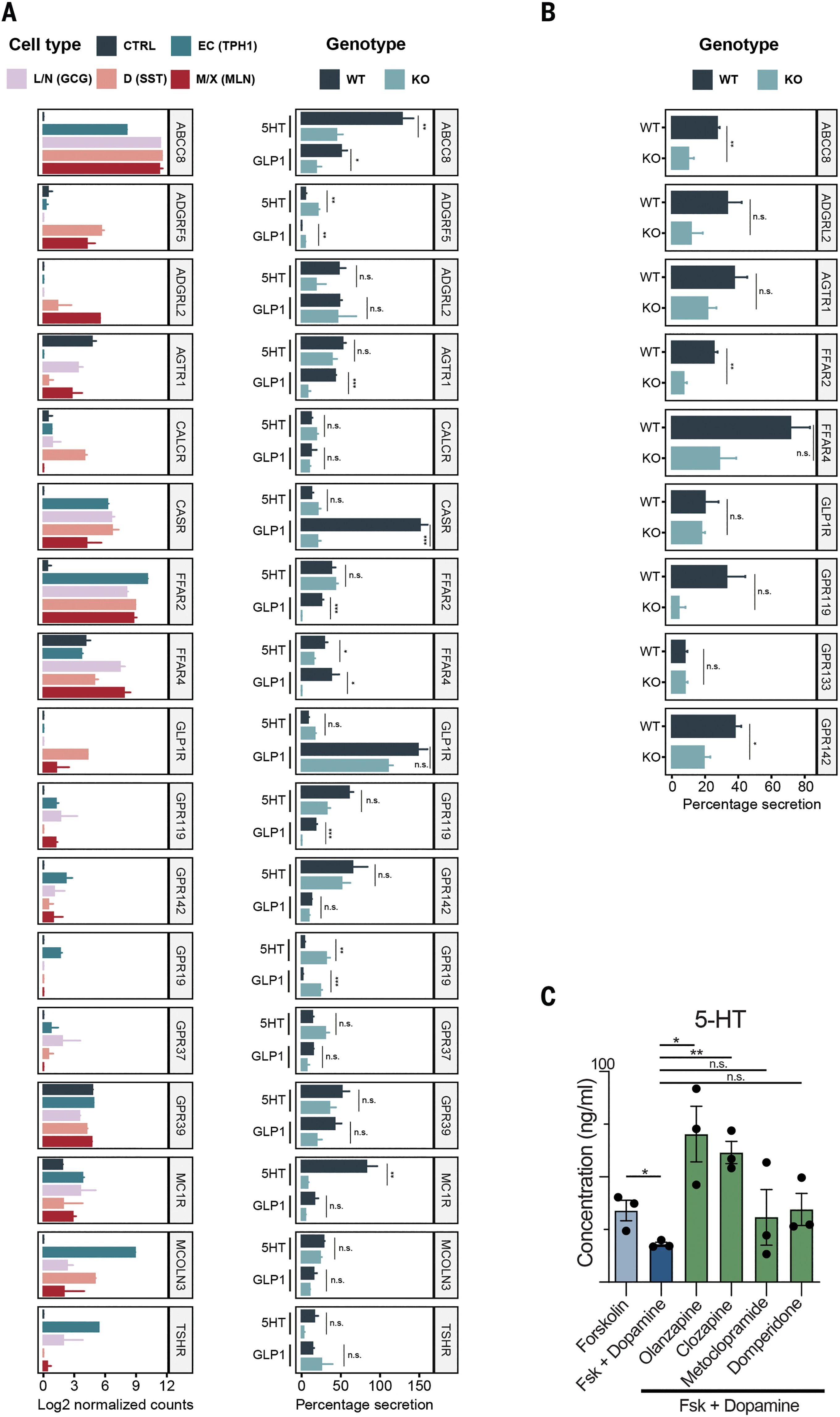
圖7:受體缺陷型(KO)和野生型(WT)類器官的激素分泌測試
(來源:參考資料[3])
05 結論與展望
基于EECs的藥物開發目前圍繞著兩條思路展開,即生成激素模擬物,或刺激EECs受體以控制多種激素產物的局部分泌。相關研究需要深度的EECs受體轉錄組數據集,與包含每種EECs類型的體外模型。
本研究中,研究人員開發了新的胃內分泌細胞分化方法,結合此前的研究為整個胃腸道EECs生成了更深度的轉錄組數據集,并創建了受體突變體生物庫用以功能篩選,最終得到了調控GLP-1等激素釋放的多種GPCR和通道蛋白,可作為開發口服腸促胰島素等療法的研究基礎。
總之,本文提出的胃腸道類器官EEC可作為體外功能研究平臺,對未來EECs的功能探索和藥物開發具有重要意義。
近岸蛋白具備多種經類器官培養驗證的細胞因子,讓您的類器官培養更可控!
參考資料
1. Worthington, J J et al. “Enteroendocrine cells-sensory sentinels of the intestinal environment and orchestrators of mucosal immunity.” Mucosal immunology vol. 11,1 (2018): 3-20. doi:10.1038/mi.2017.73
2. Beumer, Joep et al. “High-Resolution mRNA and Secretome Atlas of Human Enteroendocrine Cells.” Cell vol. 181,6 (2020): 1291-1306.e19. doi:10.1016/j.cell.2020.04.036
3. Beumer, Joep et al. “Description and functional validation of human enteroendocrine cell sensors.” Science (New York, N.Y.) vol. 386,6719 (2024): 341-348. doi:10.1126/science.adl1460
