上期我們就巨噬細胞的靶向策略進行了實例分析。在免疫細胞中,T細胞充當著不可或缺的角色。它們具有特異性和記憶性,可以被激活并產生針對病原體或腫瘤細胞的免疫反反應。T細胞分為多種類型,包括Th細胞、Tc細胞、Treg細胞等。它們在免疫系統中發揮著不同的作用。探究T細胞在免疫系統中的作用對于理解和治療與T細胞相關的疾病具有重要意義。針對T細胞的靶向策略的研究也有助于我們開發更有效的免疫治療方法。這期我們將結合實例分析T細胞在文獻中利用AAV的靶向策略。
The TLR9-MyD88 pathway is critical for adaptive immune responses to adenoassociated virus gene therapy vectors in mice [1]

主要內容
在這篇研究表明AAV通過TLR9激活小鼠漿細胞DCs,產生Ⅱ型FNs。在體內,TLR9-MyD88途徑對于AAV激活CD8 T細胞以及特異性的AAV中和抗體的產生至關重要。研究人員還證明,TLR9依賴性激活針對AAV的適應性免疫是由I型IFNs介導的,人類pDCs可以在體外被激活以誘導I型IFN的產生,這些結果都揭示了TLR9-MyD88Ⅰ型IFN途徑的重要作用,干擾這一途徑可能會改善AAV介導的人類基因治療的結果。
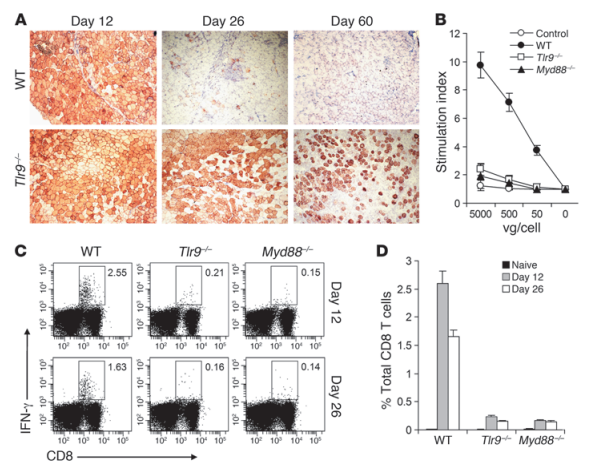
如下圖,研究人員為了確定TLR9-MyD88途徑的生物學意義,建立了一個小鼠骨骼肌介導的基因轉移模型。A可以看出AAV2-HA的表達是暫時的,60天完全消失。B圖展示了標準的T細胞增殖實驗分析了脾細胞的病毒特異性T細胞的激活情況。在WT小鼠中,AAV感染導致強大的T細胞激活,而在Tlr9-/-或Myd88-/-小鼠中,T細胞的激活被明顯削弱了。這些結果表明,TLR9-MyD88途徑是激活AAV特異性T細胞的關鍵,導致轉基因在體內表達的損失。之后研究人員進一步對細胞毒性的CD8 T細胞對AAV2外殼的反應進行了研究。在Tlr9-/-或Myd88-/-小鼠中,CD8+T細胞對AAV外殼的反應對比WT都有明顯減少。這些結果都表明,完整的TLR9-MyD88途徑是必需的。
病毒產品 | AAV2-CMV |
實驗動物 | C57BL/6& BALB/C |
注射方式 | 腹腔注射 |
注射量 | 1×1011 vg |
An evolved AAV variant enables efficient genetic engineering of murine T cells[2]

主要內容
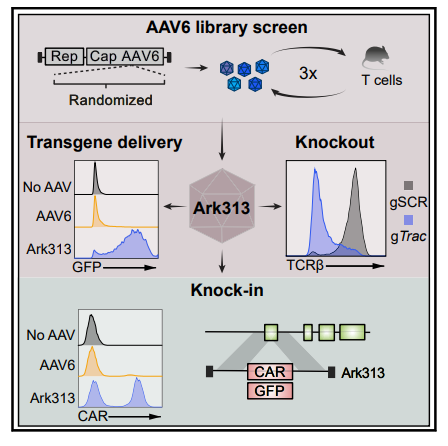
該研究在AAV6的基礎上進化出了一種能夠高效轉導小鼠T細胞的AAV變體Ark313,并通過CRISPR全基因組篩選確定了QA2是Ark313高效轉導的重要因素。Ark313能夠實現向小鼠T細胞的高效轉基因遞送和大片段DNA的有效精確靶向整合,可用于構建更安全更精確的CAR-T和TCR-T細胞。
利用同源定向修復(HDR)將大片段DNA精確靶向并插入到T細胞,已經成為T細胞療法的變革性手段。使用腺相關病毒(AAV)來遞送大片段DNA模板,大大提高了基因插入的效率,但目前仍然缺少一種高效轉導T細胞的AAV血清型。為了實現在小鼠T細胞中的靶向基因敲入,研究團隊構建了一基于在AAV6型(AAV6)的AAV衣殼庫,在此基礎上改造進化出了新的AAV血清型——Ark313,其在小鼠T細胞中表現出高轉導效率。研究團隊還通過基于CRISPR的全基因組敲除篩選,確定小鼠QA淋巴細胞抗原2(QA2)是Ark313能夠高效感染的重要因素。接下來,研究團隊證明了Ark313可實現對小鼠T細胞高效的不整合的DNA遞送、CRISPR-Cas9介導的基因敲除,以及大片段DNA的定向整合。
更重要的是,Ark313能夠用于構建TRAC靶向的CAR-T細胞和轉基因的TCR-T細胞。這一高效的靶向小鼠T細胞的腺相關病毒血清型為改進T細胞療法提供了巨大潛力,也為T細胞免疫學研究開辟了新的道路。
病毒產品 | Ark313-U6 |
注射方式 | 直接分離培養原代T細胞 |
注射量 | MOI=1*104 |
Optimizing rAAV6 transduction of primary T cells for the generation of anti-CD19 AAV-CAR-T cells[3]

主要內容
rAAV是目前最廣泛使用的基因傳遞載體,其優點是免疫原性低,幾乎沒有毒性。然而它對原代細胞的轉染效率低,特別是T淋巴細胞。在這項研究中,研究人員優化了rAAV6轉導原代T細胞的方案,顯著提高了rAAV6傳遞的CAR基因的表達效率,并成功產生了基于rAAV6的CAR-T細胞(AAV-CAR-T)。此外本研究還表明,rAAV6有效地轉導了用OKT3(CD3單克隆抗體)和GENISTEIN(酪氨酸蛋白酶抑制劑)刺激的T細胞。基于上述優化的方法,用rAAV6制備的CAR-T細胞顯示出明顯的體外和體內的抗腫瘤能力。本研究結果建立了一種高效的AAV轉導T細胞的方法,并將為CAR-T細胞的制備提供一種替代方法。
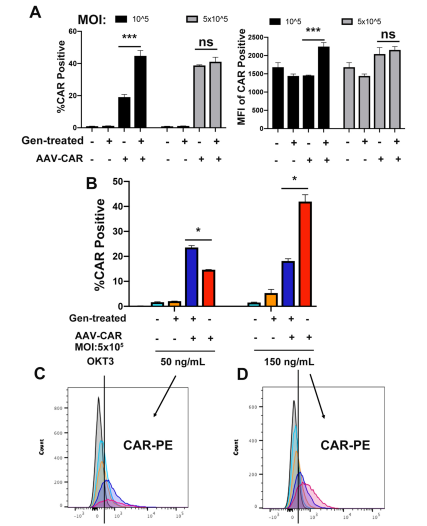
如下圖,為了證實優化的方法是否也能提高CAR在T細胞中的表達效率,研究人員使用攜帶CAR的rAAV6在CMV啟動子的控制下轉染Jurkat細胞。如A所示,基因改造組的CAR表達量從20%提高到了44%。原代T細胞培養7-10天進行細胞擴增,然后用rAAVCMV-CAR病毒進行轉導。在MOI為5 *105時,經過GENISTEIN處理的原代T細胞轉導效率增加了23%。此外,在高濃度的OKT3(150納克/毫升)條件下,CAR的表達效率在5*105的MOI下增加了40%。
病毒產品 | AAV6-CMV |
實驗動物 | C57BL/6& BALB/C |
注射方式 | 腹腔注射 |
注射量 | 1×1011 vg |
拓展閱讀
AAV在免疫細胞中的靶向策略(實例分析篇之巨噬細胞)

公眾號底部菜單欄【新功能】上線!
病毒實驗幫
免費在線學習《國自然熱點研究》、《數據庫及軟件操作教程》
一鍵下載《病毒使用手冊》、《高分文獻》
還有不定時的送新書、抽獎活動,趕緊來掃碼關注一波吧
參考文獻…
1. Zhu, J., X. Huang, and Y. Yang, The TLR9-MyD88 pathway is critical for adaptive immune responses to adeno-associated virus gene therapy vectors in mice. J Clin Invest, 2009. 119(8): p. 2388-98.
2. Nyberg, W.A., et al., An evolved AAV variant enables efficient genetic engineering of murine T cells. Cell, 2023. 186(2): p. 446-460 e19.
3. Wang, D., et al., Optimizing rAAV6 transduction of primary T cells for the generation of anti-CD19 AAV-CAR-T cells. Biomed Pharmacother, 2022. 150: p. 113027.
