人畜共患病(Zoonoses)指可自然地在人類與脊椎動物間傳播的疾病,占新發傳染病的75%以上。蝙蝠被認為是包括SARS、COVID-19等冠狀病毒,以及亨尼帕病毒等多種人畜共患病原的天然宿主。然而,由于缺乏體外生理相關的實驗模型,目前絕大多數通過宏基因組學發現的蝙蝠病毒仍未能被成功分離與培養,極大限制了對其致病性、傳播路徑及跨種傳播風險的系統研究。
2025年5月15日,韓國大田基礎科學研究所聯合成均館大學等團隊在頂刊Science發表了題為“Diverse bat organoids provide pathophysiological models for zoonotic viruses”的論文,首次建立了橫跨五種蝙蝠物種與四種器官類型的類器官資源庫,不僅填補了當前蝙蝠-病毒互作模型的空白,更成功使用該類器官庫分離了兩種新型蝙蝠源病毒。抗病毒藥物療效測試中,該類器官庫表現出比傳統細胞系(如Vero E6細胞)更高的敏感性和特異性。至此,本研究為傳染病構筑了全新的病毒溯源與藥物篩選的實驗平臺。

01 類器官庫的構建
研究團隊從東亞地區獲得的五種蝙蝠(包括大蹄蝠、中華菊頭蝠、東亞家蝠、山蝠與阿拉善伏翼蝠)中分離組織樣本,成功構建了呼吸道(氣管、肺泡)、腎臟、小腸等四類類器官模型。
其中,氣管與肺泡類器官培養時添加了R-spondin1、Noggin、FGF10、FGF7及A83-01(TGF-β抑制劑)等因子,腎臟類器官則在此基礎上補充了CHIR-99021與EGF以維持腎前體分化能力。小腸類器官培養基中則添加了EGF, Noggin, R-spondin1、Wnt信號激動劑等。
多重免疫組化和scRNA-seq確認,獲得的類器官系統高度還原了原代組織結構與細胞多樣性。如在氣管類器官中,研究人員檢測到了豐富的纖毛細胞、基底干細胞和黏液細胞,而在肺部類器官中,支氣管和肺泡上皮細胞的復雜結構也得到了很好的模擬。
四種類器官可在體外穩定培養超過6個月,并通過冷凍復蘇維持表型不變,至此研究人員已成功建立4類可模擬蝙蝠器官生理特征的體外平臺。
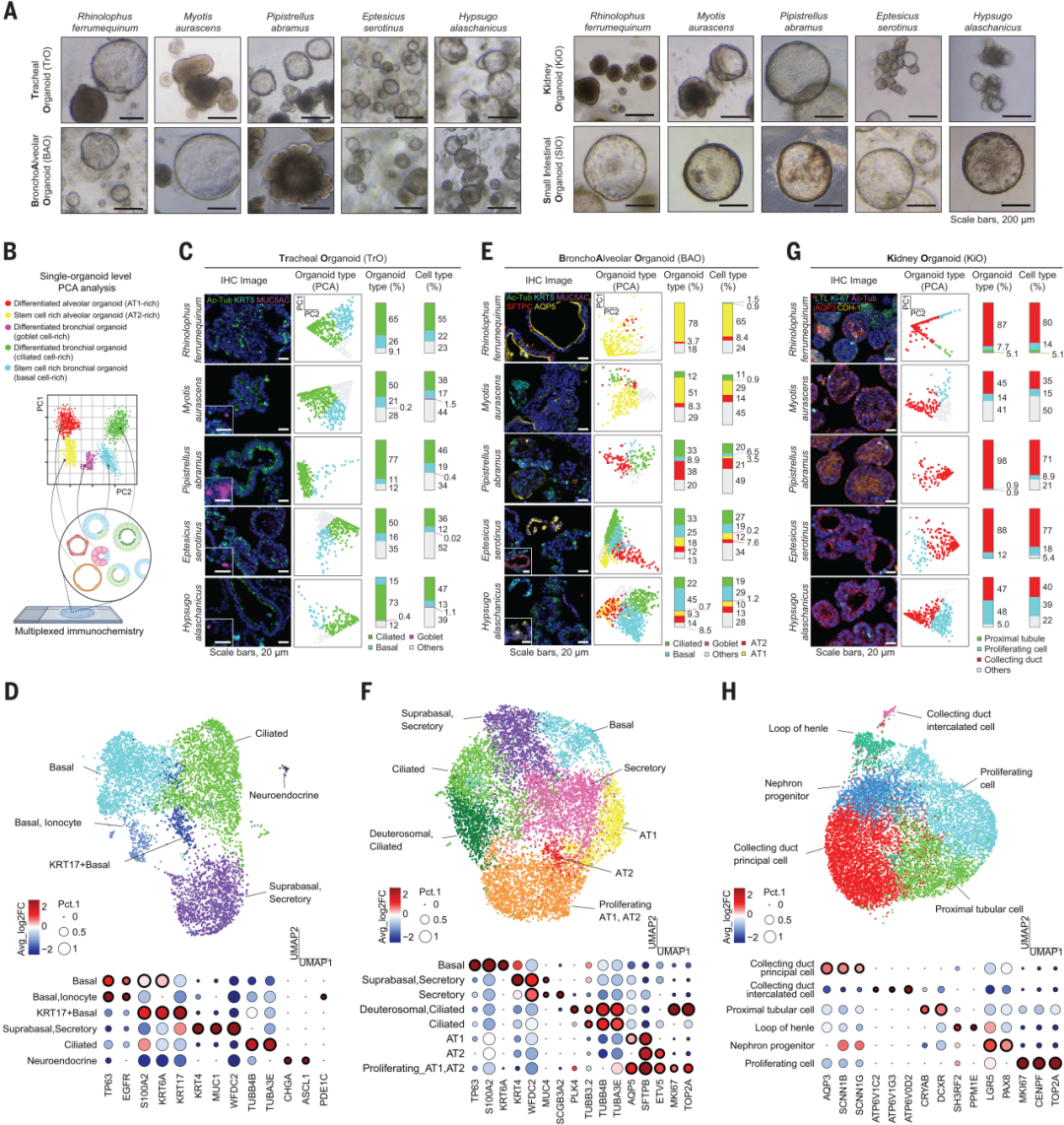
圖1:來自5種蝙蝠的4種類器官的建立
02 多重病毒感染模型
為驗證該平臺在病毒學研究中的適用性,研究團隊選擇了多種代表性病毒株構建感染模型。
結果顯示,SARS-CoV-2在除中華菊頭蝠小腸類器官外的所有小腸或呼吸道類器官中無法有效復制,表明SARS-CoV-2對中華菊頭蝠具有物種特異性。
相比之下,中東呼吸綜合征冠狀病毒(MERS-CoV)在三種蝙蝠的氣管與肺泡類器官中均表現出高效復制,且病毒與受體DPP4的相互作用在蝙蝠和人類中保守。該發現支持MERS-CoV存在跨蝙蝠物種的宿主適應性,且可能為人類感染的自然中間宿主提供了更合理的解釋路徑。
禽源與人源流感病毒方面,H1N1與H9N2在多數類器官中均具感染性,但H5N1感染能力更強,且更具致病潛力。
值得注意的是,RNA-seq分析結果顯示,MERS-CoV及IAV(人H1N1 CA04)感染均能顯著誘導干擾素刺激基因ISGs的表達,表達水平與病毒感染的強度密切相關,且不同病毒誘導的ISGs存在差異。
以上結果表明,蝙蝠類器官能夠有效地模擬病毒感染引起的免疫反應,為研究蝙蝠在病毒感染中的免疫機制提供了重要工具。
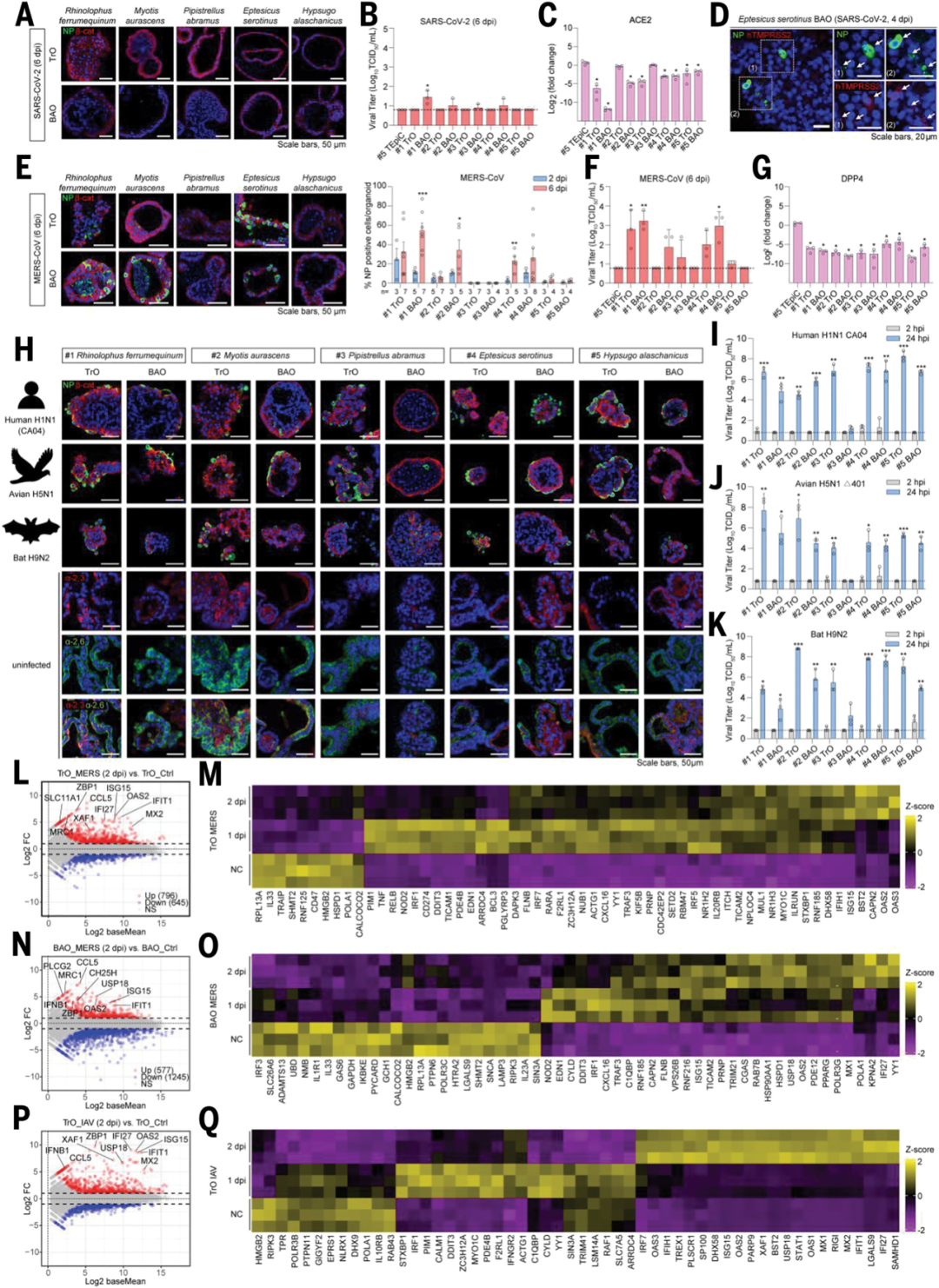
圖2:多種蝙蝠呼吸道類器官對人畜共患病毒的感染模型
03 類器官:原代病毒分離平臺
通過將蝙蝠糞便及腸內容物樣本接種至原代小腸與腎類器官中,研究團隊成功分離出兩種病毒。其在蝙蝠類器官中能夠高效復制,并且能夠誘導ISGs的表達。基因組測序和同源性分析顯示,分離的病毒與已知蝙蝠病毒存在顯著差異,表明其有極大可能是新發現的蝙蝠病毒。
值得注意的是,這些病毒在傳統細胞系(如MARC-145)中無法穩定傳代,僅能在類器官或初級細胞中維持活性,凸顯了類器官平臺在病毒分離及培養中的獨特價值。
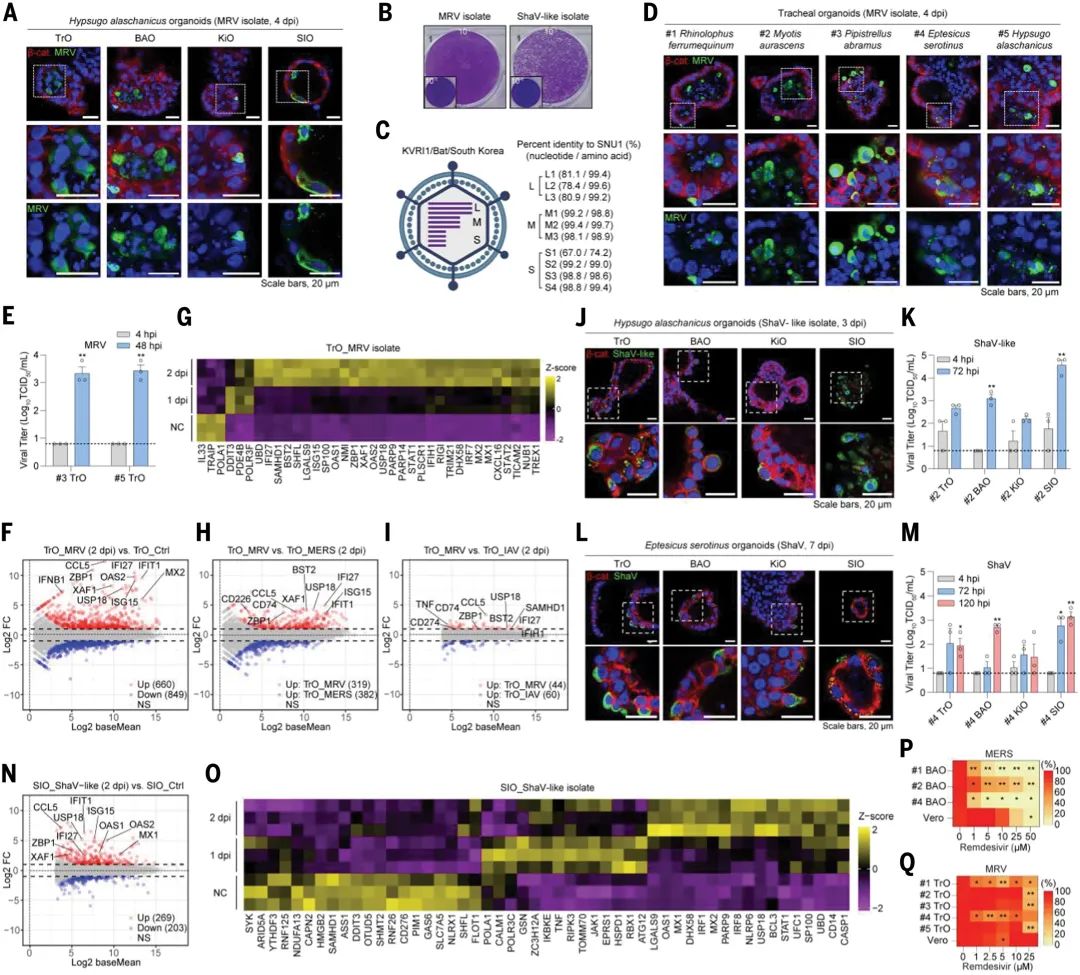
圖3:使用多物種和多器官蝙蝠類器官平臺分離和表征新型病毒
04 抗病毒篩選平臺
最后,為驗證類器官作為抗病毒藥物篩選平臺的潛力,團隊將3D類器官轉化為Matrigel包被的2D板式系統,在含EGF與Y-27632的誘導培養基中恢復72小時后進行病毒感染,測試確認了瑞德西韋(Remdesivir)等藥物抑制MERS-CoV和MRV在蝙蝠類器官中復制的能力。
此外,研究人員還發現,蝙蝠類器官在測試抗病毒藥物時表現出比傳統細胞系(如Vero E6細胞)更高的敏感性和特異性。
05 總結
該研究首次建立了“多物種-多器官”蝙蝠類器官資源,從而提供了一種低風險、高保真度的新型病毒感染平臺。相比傳統細胞系,蝙蝠類器官對分離的原代病毒具有更高的培養穩定性,對抗病毒藥物表現出更高的敏感性與特異性,因此在病毒溯源、傳播機制解析與快速藥篩中展示出極高的應用潛力。
不過作者也在結尾指出,該平臺仍存在一定局限,如缺乏蝙蝠參考基因組以進行遺傳分析,類器官系統中尚未整合免疫細胞,無法完全模擬體內復雜免疫-上皮互作等。未來可進一步拓展血管、神經等組織類器官,并引入免疫細胞共培養體系,構建更完整的蝙蝠微環境模擬系統,以推動類器官平臺向“微型生態系統”方向演進。
近岸蛋白相關產品
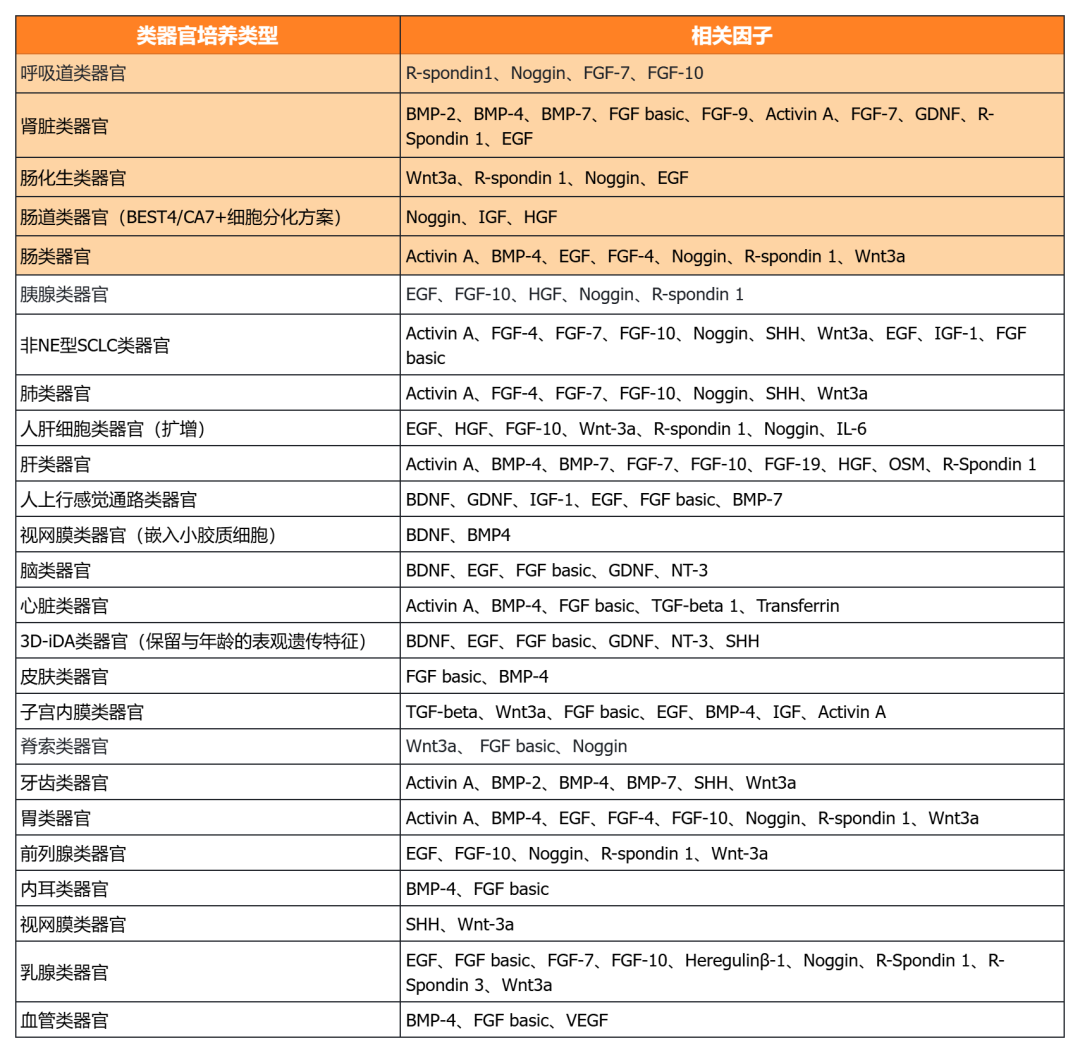
近岸蛋白提供多種類器官體外培養全方案,包括基質膠、培養基、相關細胞因子等:
經類器官培養驗證的完全培養基
經類器官培養驗證的細胞因子
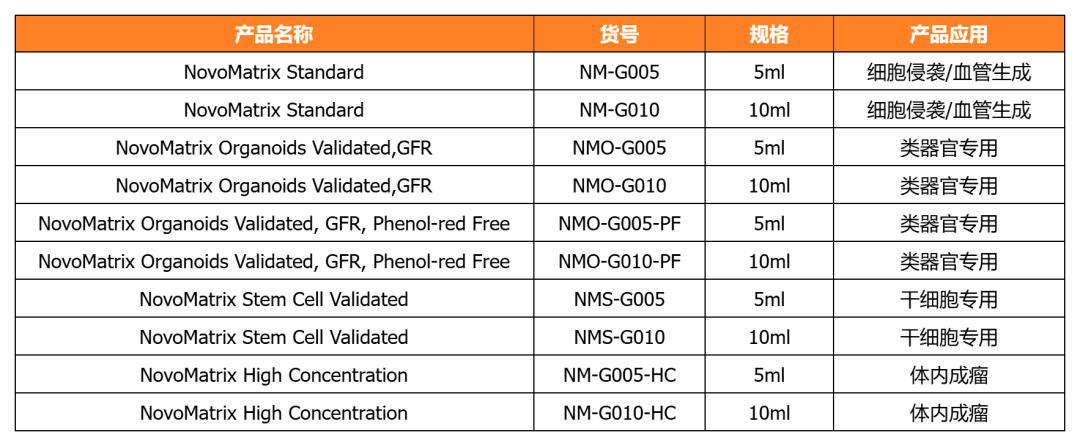
NovoMatrix 基質膠
參考資料
-
Kim, Hyunjoon et al. “Diverse bat organoids provide pathophysiological models for zoonotic viruses.” Science (New York, N.Y.) vol. 388,6748 (2025): 756-762. doi:10.1126/science.adt1438
