2024年1月22日,國家藥監局器審中心發布了關于公開征求《腫瘤篩查用體外診斷試劑臨床評價注冊審查指導原則(征求意見稿)》指導原則意見的通知。
2025年8月21日,通告落地:
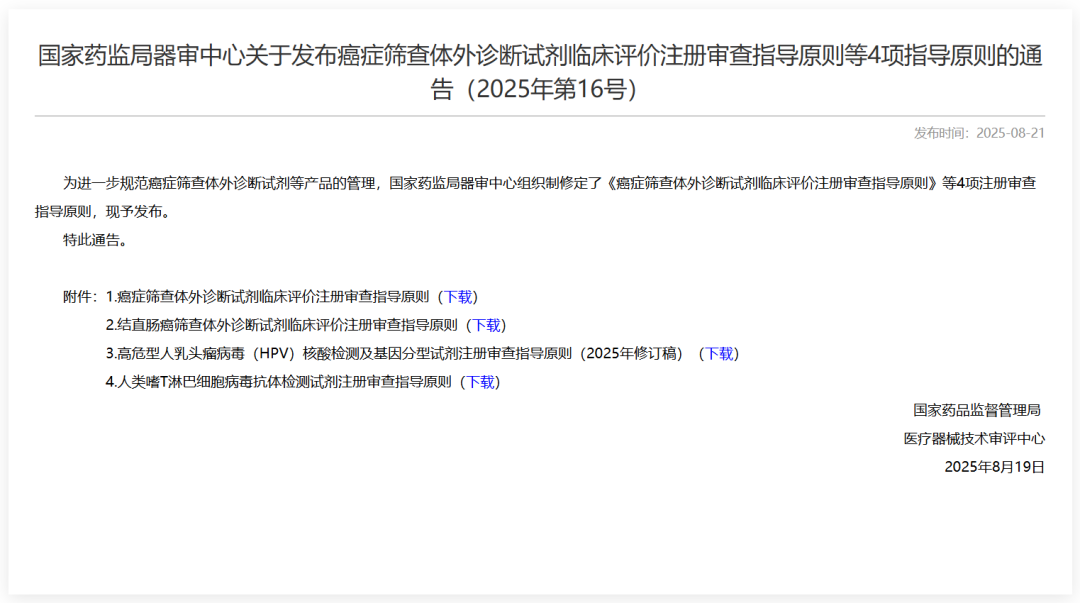
相比于征求意見稿,變化非常大,下面我們挑幾個點看對于試劑盒開發商的產品布局有哪些利好。
其一,提倡積極預防,推進早發現早診斷

其二,刪除了對于“其他癌種”的描述,增加了申報的可能性
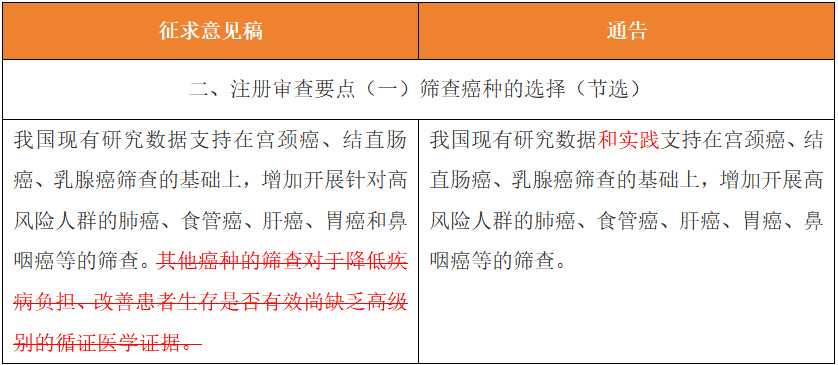
其三,解綁“符合流行病學的要求”,監管框架明確允許性能指標差異化

其四,多癌種聯合篩查產品從逐步推進到以臨床需求為導向的跨越,給了產品布局更多的機會
癌癥是全球重大公共衛生挑戰,篩查是降低死亡率的關鍵手段。近岸蛋白憑借自主核心技術平臺,開發并量產多款高性能分子酶及診斷級試劑原料,賦能診斷企業加速產品研發與產業化,攜手共建高效協同的行業生態,助力中國精準醫療高質量發展。明星產品——DNA甲基化檢測預混液通過主文檔登記備案,助力客戶申報流程更快捷。
所有者名稱:蘇州近岸蛋白質科技股份有限公司
主文檔登記事項名稱:DNA甲基化檢測預混液主文檔
主文檔登記號:M2023150-000
登記/更新時間:2023/12/8
部分產品性能展示
優異的擴增性能
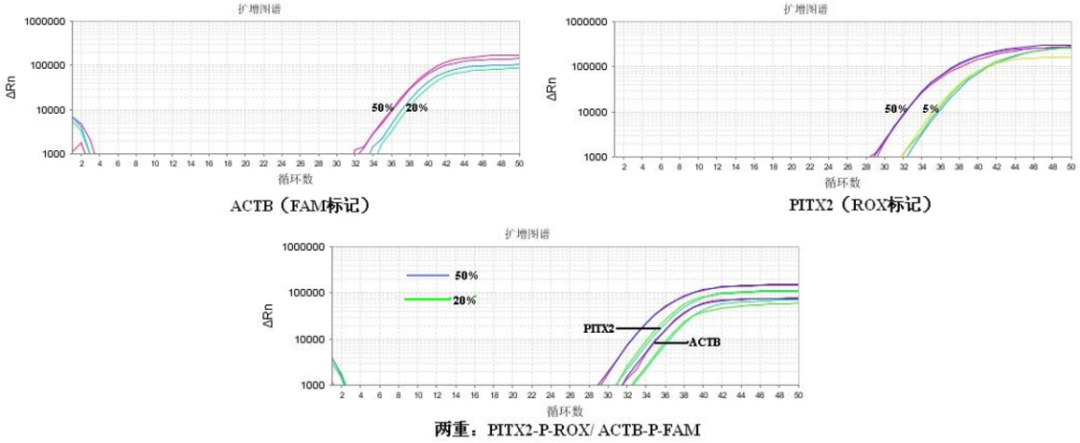
圖1. 不同甲基化水平的DNA樣本擴增
可穩定檢測到低至5%的甲基化水平
穩定性好
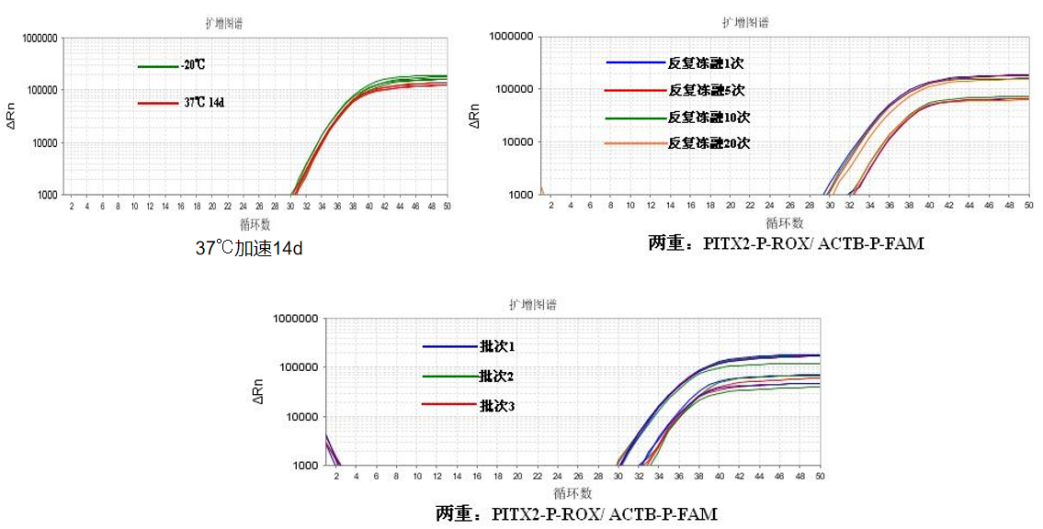
圖2. 熱加速穩定性和反復凍融測試
37℃加速14d和反復凍融20次的檢測性能跟-20℃一致,三批次差異不顯著
優化升級
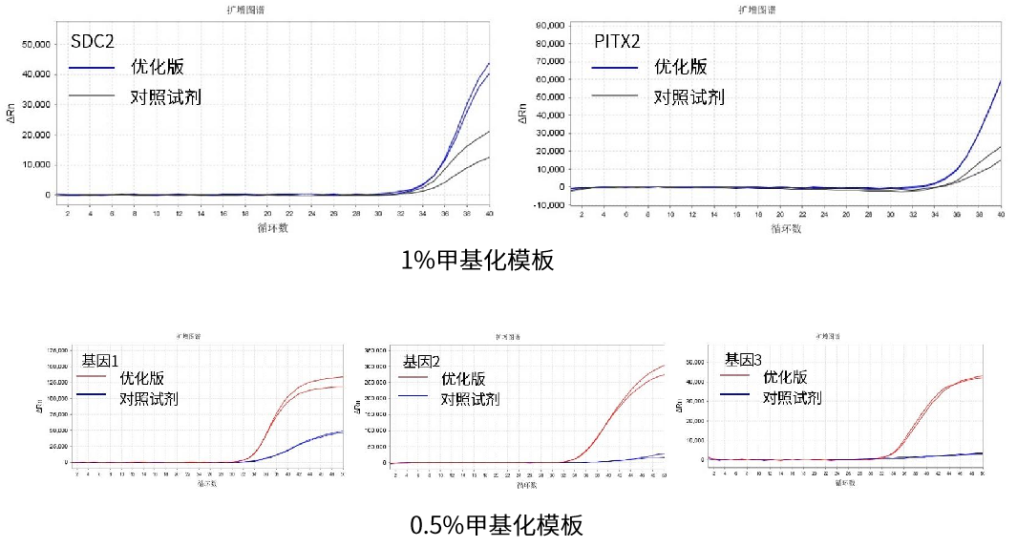
圖3. 優化版(E498)測試
優化版的檢測甲基化水平更靈敏,熒光信號更強
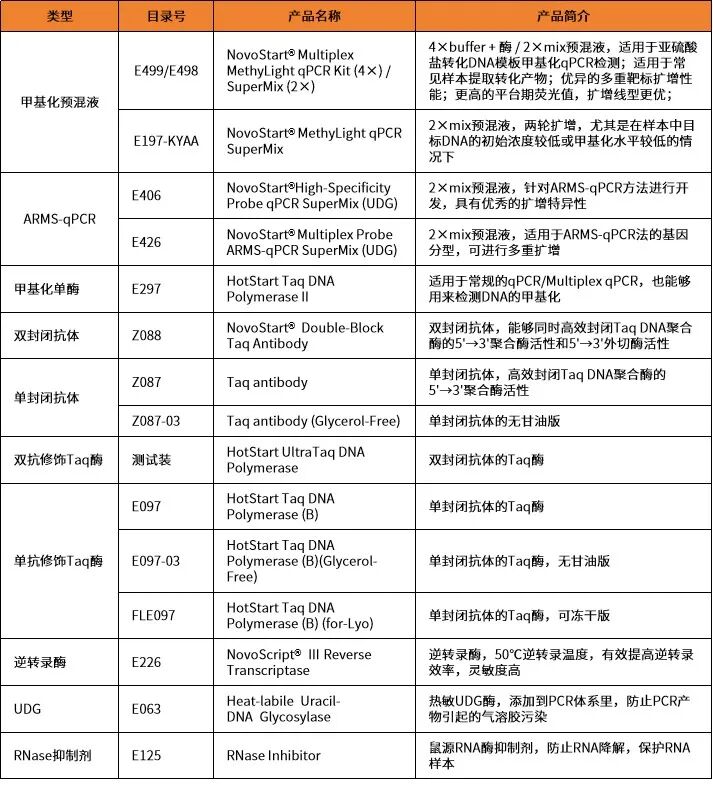
相關產品
參考文獻
[1]WHO 結直腸癌
[2]國家藥監局器審中心公開征求《腫瘤篩查用體外診斷試劑臨床評價注冊審查指導原則(征求意見稿)》意見的通知
[3]國家藥監局器審中心關于發布癌癥篩查體外診斷試劑臨床評價注冊審查指導原則等4項指導原則的通告(2025年第16號)
