Xp11.2易位性腎細(xì)胞癌(Xp11.2 tRCC)是2016 WHO分型中RCC的一個獨(dú)立亞群,其特點(diǎn)是轉(zhuǎn)錄因子E3 (TFE3)融合基因高表達(dá)導(dǎo)致患者預(yù)后不良[1]。越來越多的研究表明,這些高表達(dá)的TFE3融合蛋白可以通過直接或間接調(diào)控下游靶基因,作為癌癥的主要驅(qū)動因子。
環(huán)狀RNA(circRNAs)是一類功能性非編碼RNA (ncRNAs),具有由前體mRNA剪接或跳過事件形成的環(huán)狀結(jié)構(gòu),不存在5'末端帽子和3'末端poly(A)尾巴[2]。由于環(huán)狀結(jié)構(gòu),環(huán)狀RNA對外切酶具有抗性,因此它們的半衰期比線性RNA更長。越來越多的證據(jù)表明,環(huán)狀RNA在癌癥的發(fā)生和進(jìn)展中發(fā)揮了重要作用[3]。然而環(huán)狀RNA與tRCC腫瘤發(fā)生相關(guān)潛在的分子機(jī)制尚不清楚。
近期,南京大學(xué)醫(yī)學(xué)院李冬梅/甘衛(wèi)東團(tuán)隊(duì)在Molecular Cancer雜志上發(fā)表題為CircMET promotes tumor proliferation by enhancing CDKN2A mRNA decay and upregulating SMAD3的研究論文,詳細(xì)闡述了circMET在腫瘤中調(diào)控細(xì)胞增殖的功能及機(jī)制[4]。

01 CircMET在NONO-TFE3 tRCC中顯著高表達(dá)
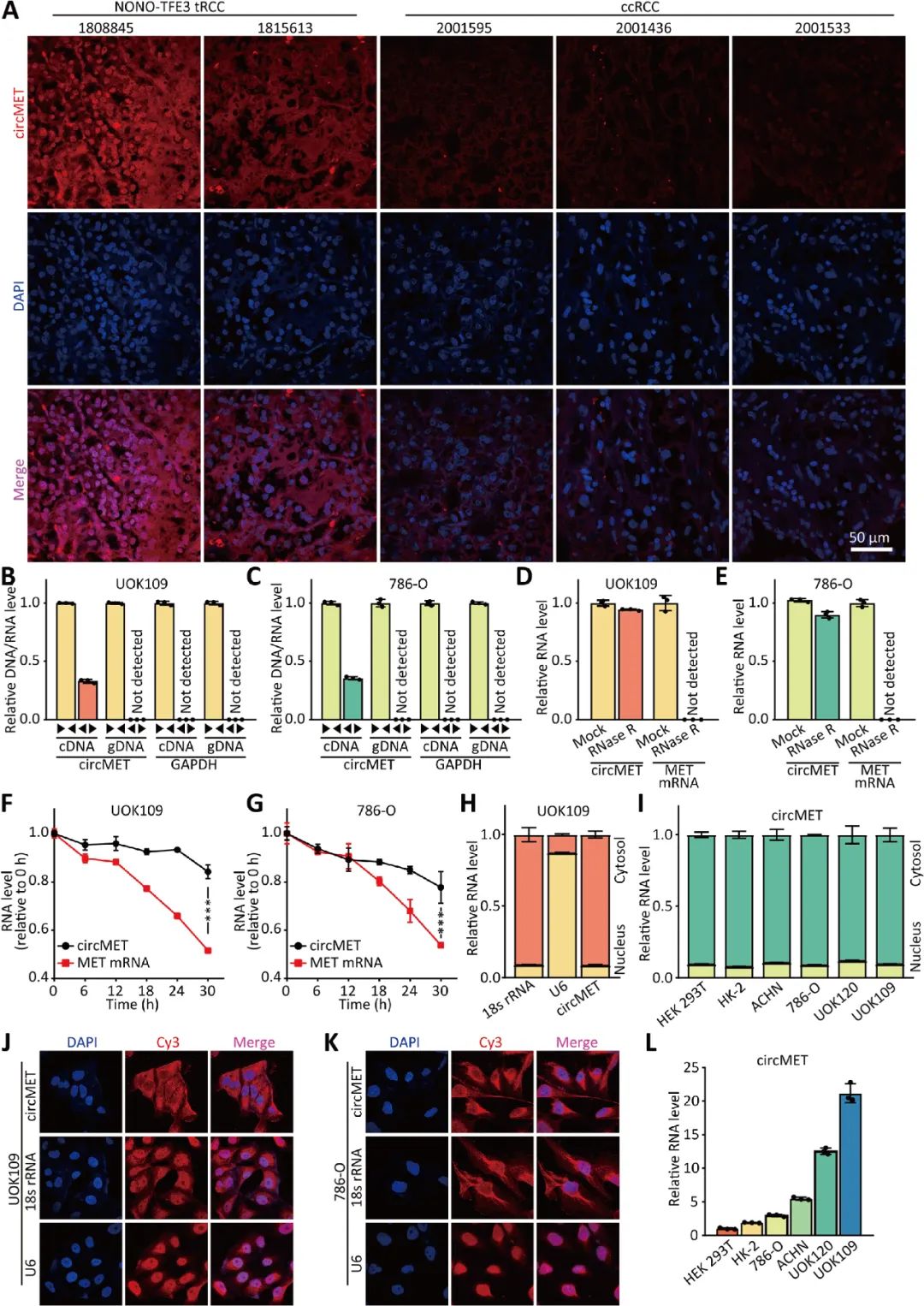
02 CircMET促進(jìn)NONO-TFE3 tRCC的增殖
為了確定circMET在NONO-TFE3 tRCC的生物學(xué)行為中的功能作用,作者研究了上調(diào)或下調(diào)circMET對癌細(xì)胞生長的影響。體外細(xì)胞和體內(nèi)成瘤實(shí)驗(yàn)結(jié)果表明circMET促進(jìn)NONO-TFE3 tRCC的增殖(圖2)。
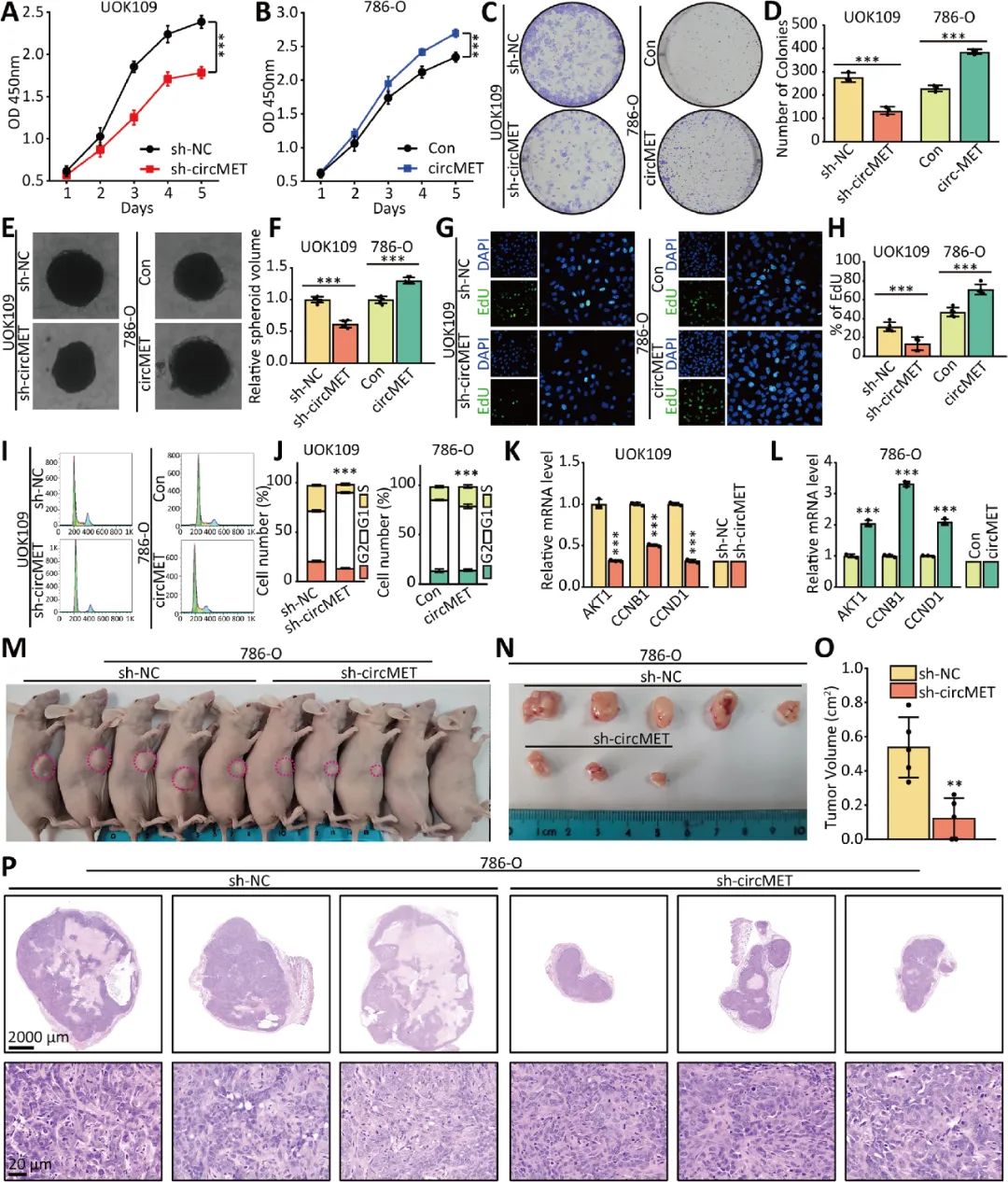
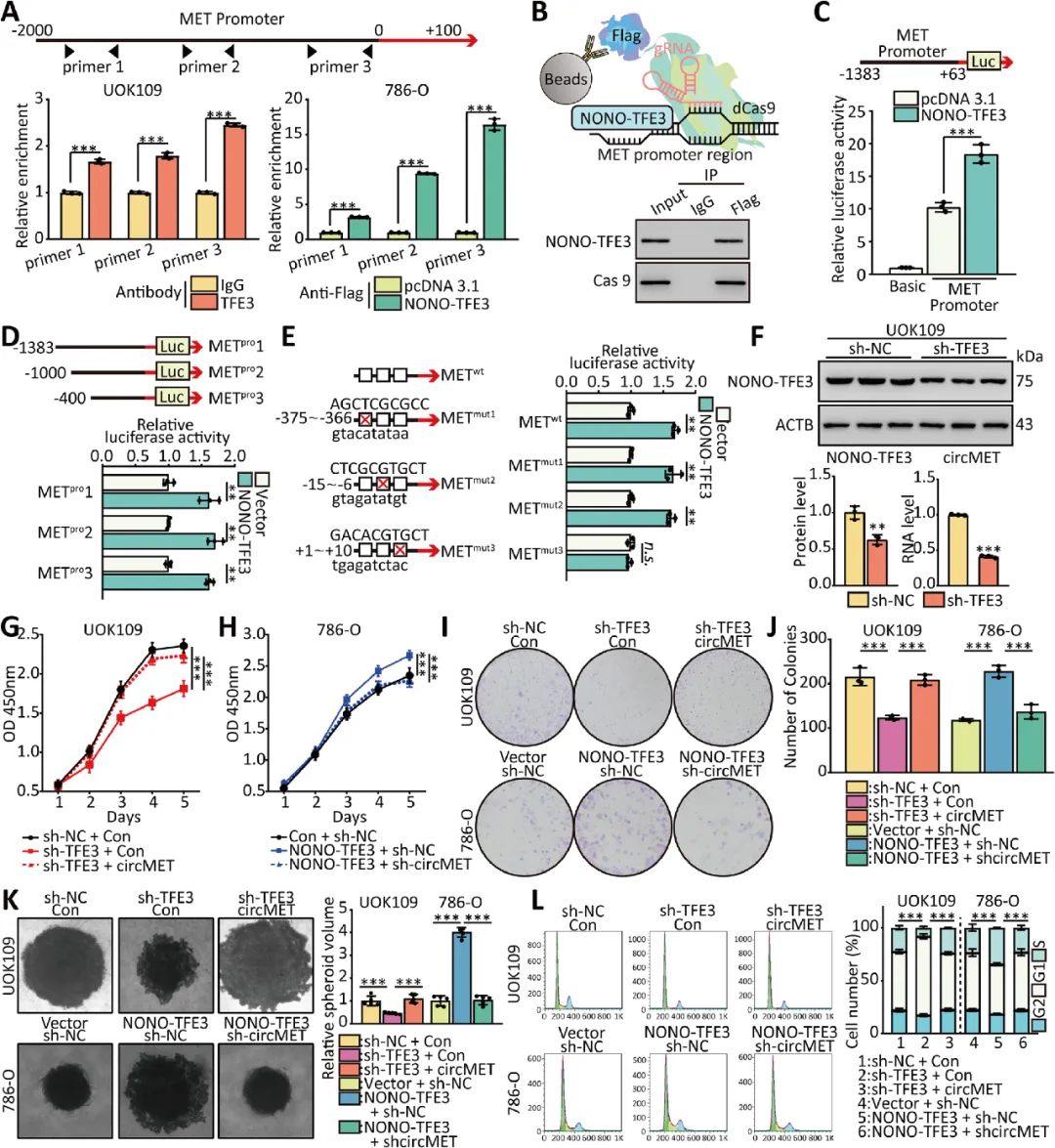
03 NONO-TFE3增強(qiáng)了circMET的轉(zhuǎn)錄
研究人員通過體外功能缺失和功能獲得改變NONO-TFE3蛋白水平,并分別檢測UOK109和786-O細(xì)胞中circMET的表達(dá)。雙螢光素酶酶實(shí)驗(yàn)等表明NONO-TFE3通過上調(diào)circMET的表達(dá)促進(jìn)NONO-TFE3 tRCC的進(jìn)展(圖3)。
04 CircMET通過YTHDC1以m6A依賴的方式輸出到細(xì)胞質(zhì)中
YTHDC1作為m6A解讀器蛋白的一員,已知參與RNA剪接和RNA核輸出,研究團(tuán)隊(duì)進(jìn)一步通過CRISPR/dCas13構(gòu)建的靶向去修飾系統(tǒng)證實(shí),YTHDC1可通過m6A依賴性的方式促進(jìn)circMET出核并發(fā)揮功能(圖4)。

05 CircMET通過直接結(jié)合下調(diào)CDKN2A mRNA
circMET已被證實(shí)能促進(jìn)NONO-TFE3 tRCC的增殖,作者進(jìn)一步研究circMET是否能調(diào)控與細(xì)胞周期相關(guān)的基因表達(dá),沉默circMET后螢光素酶活性上調(diào)最明顯的是CDKN2A。CDKN2A是一種腫瘤抑制基因,編碼p16蛋白,抑制細(xì)胞周期。實(shí)驗(yàn)證實(shí)circMET通過直接結(jié)合下調(diào)CDKN2A mRNA的穩(wěn)定性來促進(jìn)腫瘤的生長(圖5)。
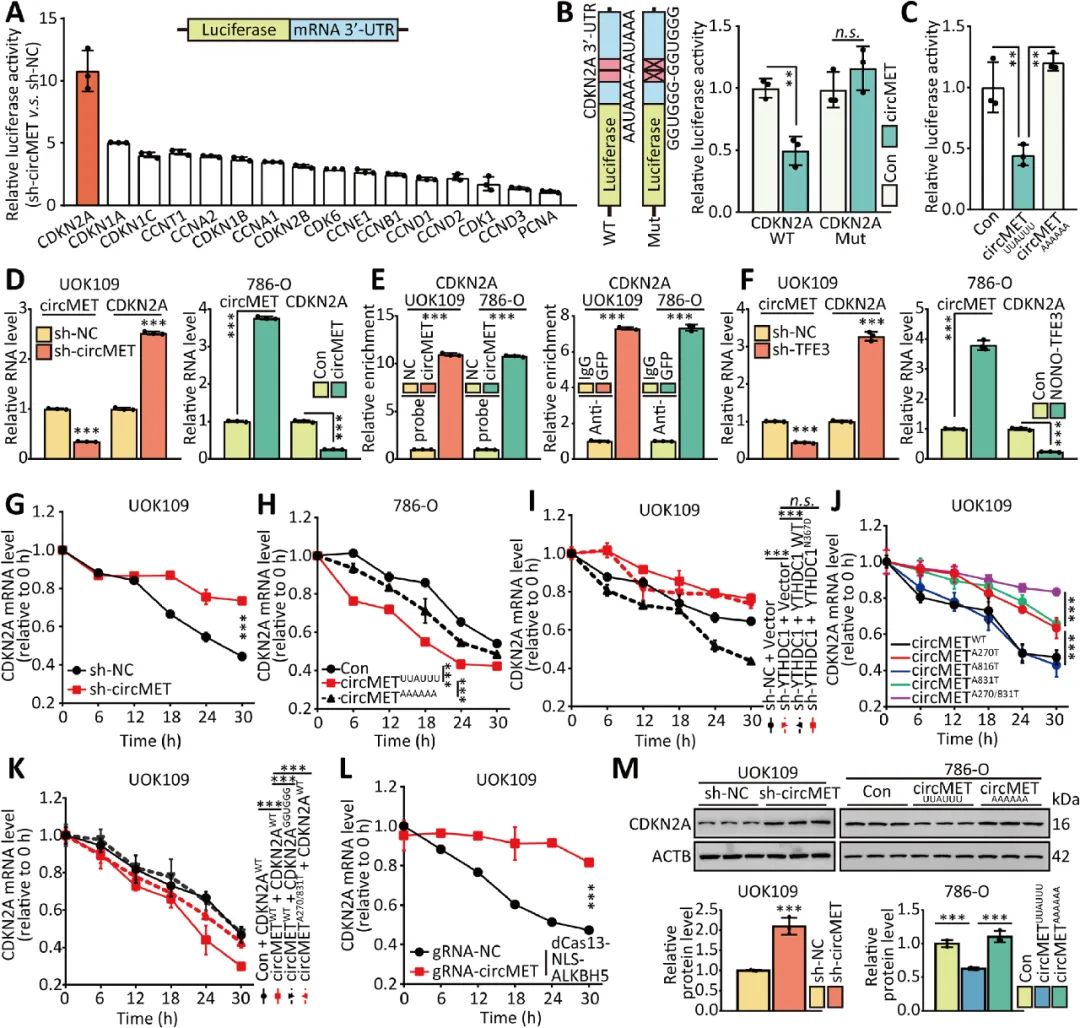
06 CircMET通過招募YTHDF2來加速CDKN2A mRNA的衰減
研究人員進(jìn)一步證實(shí)circMET通過與CDKN2A mRNA 3’UTR直接結(jié)合,并且募集m6A閱讀蛋白YTHDF2調(diào)控CDKN2A mRNA的降解。circMET募集YTHDF2至CDKN2A mRNA的過程中,YTHDF2直接結(jié)合在circMET的m6A修飾位點(diǎn),并參與CDKN2A mRNA的降解過程,而YTHDF2并未直接結(jié)合CDKN2A mRNA上的m6A修飾位點(diǎn)(圖6)。
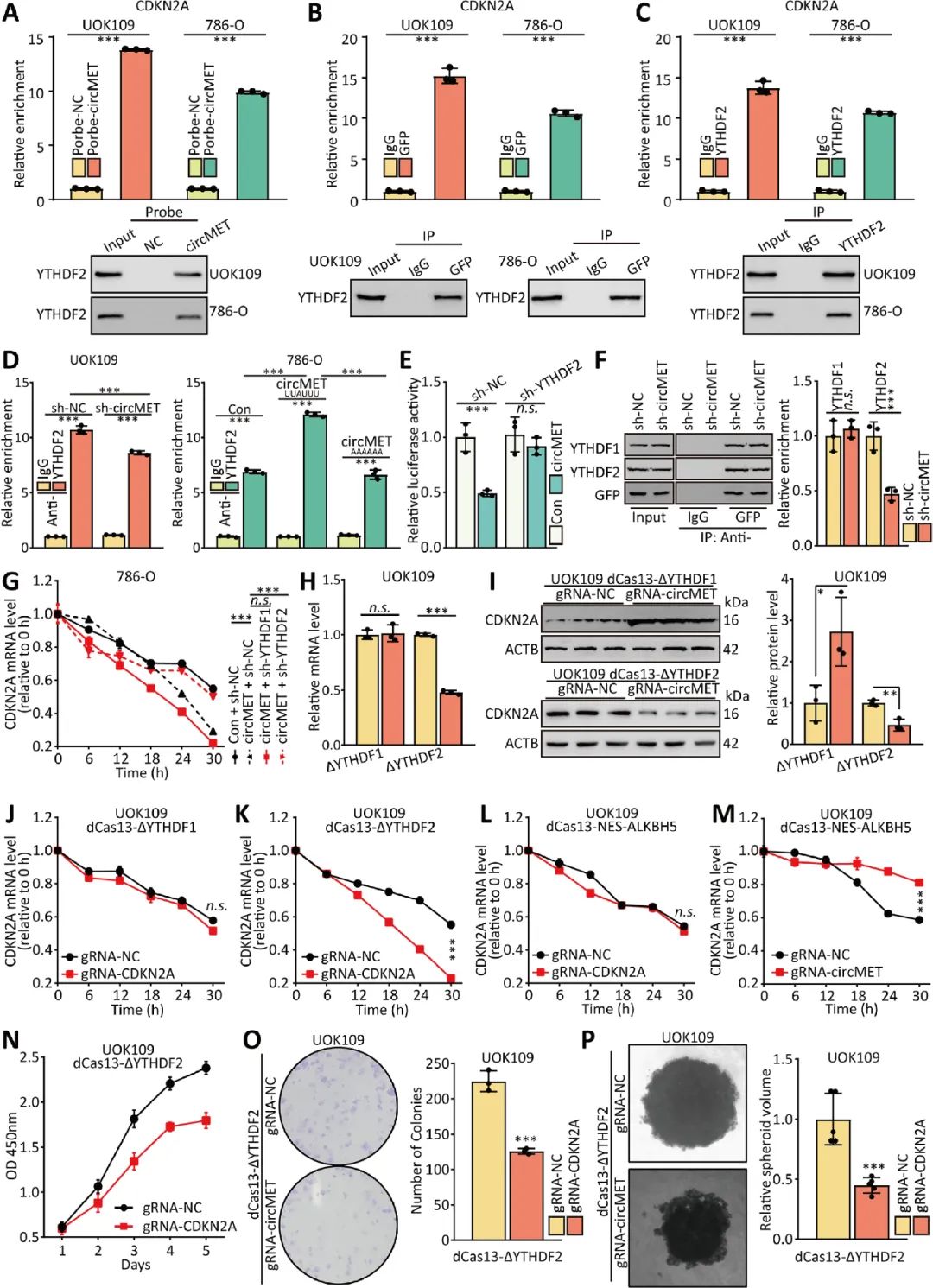
07 CircMET作為ceRNA來海綿吸收miRNAs
大量研究證實(shí),環(huán)狀RNA作為mirRNA的生物海綿,在調(diào)控基因表達(dá)中發(fā)揮重要作用。circMET在細(xì)胞內(nèi)的分布提示circMET可能也具有轉(zhuǎn)錄后調(diào)控功能,有助于NONO-TFE3 tRCC的增殖。通過軟件預(yù)測和螢光素酶等實(shí)驗(yàn)證實(shí)miR-1197是circMET潛在的miRNA靶點(diǎn),細(xì)胞水平驗(yàn)證circMET作為ceRNA對miR-1197具有海綿吸附作用(圖7)。
?
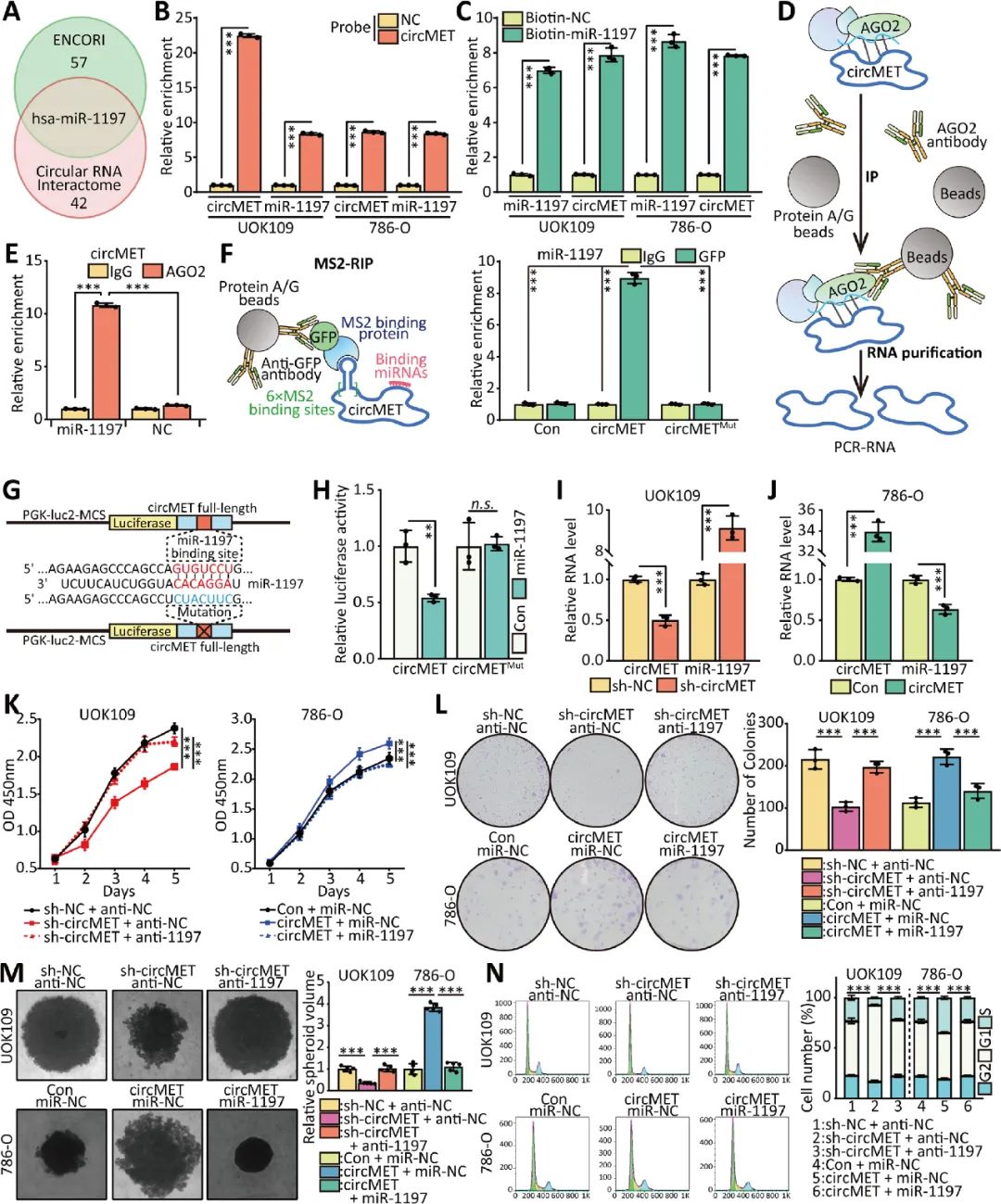
08 CircMET通過轉(zhuǎn)錄后調(diào)控SMAD3的表達(dá)
雙螢光素酶檢測結(jié)果顯示,過表達(dá)miR-1197后,螢光素酶活性下調(diào)最明顯的是SMAD3, miR-1197可以結(jié)合SMAD3 mRNA的3’UTR,并介導(dǎo)NONO-TFE3 tRCC中SMAD3的表達(dá)水平。circMET可以通過充當(dāng)miRNAs的“吸附劑”,通過轉(zhuǎn)錄后調(diào)控SMAD3的表達(dá)(圖8)。
?
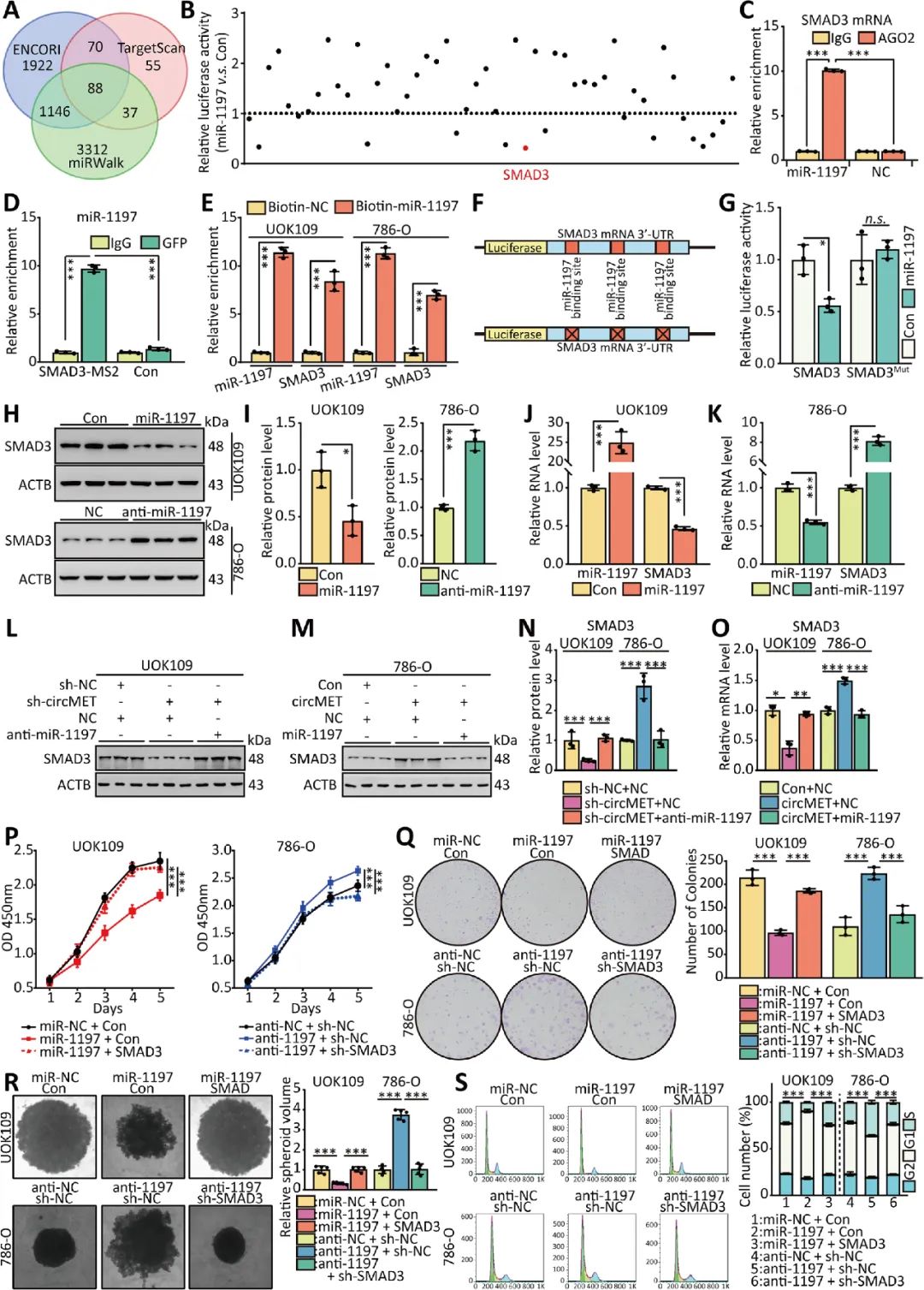
本文研究發(fā)現(xiàn)NONO-TFE3融合可上調(diào)NONO-TFE3 tRCC組織和細(xì)胞中circMET的表達(dá),過表達(dá)circMET可顯著促進(jìn)NONO-TFE3 tRCC的生長。YTHDC1通過與m6A修飾結(jié)合,促進(jìn)circMET的胞質(zhì)輸出。circMET不僅可以通過充當(dāng)miRNAs的“吸附劑”調(diào)控SMAD3的表達(dá),還可以通過直接與mRNA結(jié)合調(diào)控CDKN2A mRNA的穩(wěn)定性(圖9)。CircMET有可能成為NONO-TFE3 tRCC以及其他高表達(dá)CircMET的癌癥分子治療的新靶點(diǎn)。
和元生物有幸為本研究提供慢病毒載體構(gòu)建和病毒包裝服務(wù),用實(shí)際行動助力腫瘤研究!
參考文獻(xiàn):
[1] Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs Part A: Renal, Penile, and Testicular Tumours. Eur Urol. 2016;70:93–105. [2] Goodall GJ, Wickramasinghe VO. RNA in cancer. Nat Rev Cancer.2021;21:22–36
[3] Chen L, Shan G. CircRNA in cancer: Fundamental mechanism and clinicalpotential. Cancer Lett. 2021;505:49–57.
[4] Lei Yang, Yi Chen., et al. CircMET promotes tumor proliferation by enhancing CDKN2A mRNA decay and upregulating SMAD3. Mol Cancer.2022 Jan 18;21(1):23.doi: 10.1186/s12943-022-01497-w.
?
