當(dāng)今社會(huì),人們會(huì)不可避免地感受到來(lái)自于生活、工作、學(xué)習(xí)等各方面的壓力,亦稱(chēng)應(yīng)激(stress)。一時(shí)的壓力有助于個(gè)體做出有效的生存抉擇;但若是個(gè)體遭受到急劇、嚴(yán)重的精神創(chuàng)傷性事件后,應(yīng)激則會(huì)對(duì)身體健康產(chǎn)生不利影響,甚至?xí)l(fā)癲癇、偏頭痛和運(yùn)動(dòng)障礙等偶發(fā)性神經(jīng)系統(tǒng)疾病。因此,了解應(yīng)激源引發(fā)偶發(fā)性神經(jīng)功能障礙的機(jī)制,對(duì)于相關(guān)疾病的預(yù)防或干預(yù)措施具有重要價(jià)值。
共濟(jì)失調(diào)(Ataxia)是一類(lèi)以運(yùn)動(dòng)協(xié)調(diào)性紊亂為主要特征的神經(jīng)系統(tǒng)癥狀,臨床表現(xiàn)包括步態(tài)不穩(wěn)、喪失平衡、吞咽困難、眼球運(yùn)動(dòng)異常、肌張力受損等。其中,發(fā)作性共濟(jì)失調(diào)(Episodic Ataxia,EA)具有遺傳異質(zhì)性,病死率和病殘率較高。EA有多種類(lèi)型,發(fā)作性共濟(jì)失調(diào)I型(EA1)和發(fā)作性共濟(jì)失調(diào)II型(EA2)類(lèi)型是最為常見(jiàn)的。
EA2是由CACNA1A(編碼P/Q-型鈣通道α1亞基)基因突變引起,其特征為持續(xù)幾個(gè)小時(shí)到幾天的共濟(jì)失調(diào)發(fā)作和肌張力障礙。EA2的發(fā)作可由外部因素觸發(fā),如咖啡因、乙醇和身體或情緒壓力等。
Tottering(tg/tg)小鼠是一個(gè)遺傳性動(dòng)物模型,其P/Q-型鈣通道α1A亞單位基因畸變,該基因在小腦浦肯野高度表達(dá)。Tottering小鼠與EA2患者類(lèi)似,表現(xiàn)為輕度基線(xiàn)性共濟(jì)失調(diào),伴有由壓力或咖啡因或酒精引起的嚴(yán)重共濟(jì)失調(diào)、肌張力障礙和間歇性運(yùn)動(dòng)障礙。
近日,阿爾伯特愛(ài)因斯坦醫(yī)學(xué)院的研究團(tuán)隊(duì)基于Tottering小鼠發(fā)現(xiàn),應(yīng)激誘發(fā)的EA2運(yùn)動(dòng)障礙可能是由去甲腎上腺素激活浦肯野細(xì)胞上的α1型腎上腺素能受體(α1-Rs)導(dǎo)致的。α1-Rs通過(guò)酪蛋白激酶II(CK2)依賴(lài)的鈣調(diào)蛋白(CaM)磷酸化介導(dǎo)小電導(dǎo)鈣離子激活鉀通道(small conductance Ca2+-activated K+ channels,SK)的活性降低。從而導(dǎo)致小腦浦肯野細(xì)胞的爆發(fā)性不規(guī)則放電及運(yùn)動(dòng)功能障礙。該研究成果發(fā)表在Science Advances上,標(biāo)題為“Mechanism of stress-induced attacks in an episodic neurologic disorder”

研究者基于Tottering小鼠,借助在體電生理記錄小鼠浦肯野細(xì)胞放電模式,發(fā)現(xiàn)應(yīng)激誘發(fā)的Tottering小鼠運(yùn)動(dòng)功能障礙的發(fā)作與浦肯野細(xì)胞的高頻爆發(fā)性放電(burst firing)有關(guān)。同時(shí),采用光遺傳學(xué)、藥理學(xué)、行為學(xué)等技術(shù)發(fā)現(xiàn)下丘腦-垂體-腎上腺軸(The hypothalamic-pituitary-adrenal axis ,HPA or HTPA axis)在感受到應(yīng)激刺激時(shí)被激活,促進(jìn)大腦、小腦釋放去甲腎上腺素(norepinephrine, NE)。

?
?
隨后,研究者借助免疫熒光、免疫共沉淀(CoIP)等技術(shù)研究發(fā)現(xiàn)NE可能通過(guò)激活α型腎上腺素能受體(α1-Rs)激活誘發(fā)浦肯野細(xì)胞burst firing。α1-Rs激活通過(guò)介導(dǎo)酪蛋白激酶II(CK2)依賴(lài)的鈣調(diào)蛋白(CaM)磷酸化,導(dǎo)致小電導(dǎo)鈣離子激活鉀通道(SK)的活性降低。SK是一種依賴(lài)細(xì)胞內(nèi)鈣離子濃度升高而激活的鉀通道,其活性降低會(huì)誘發(fā)浦肯野細(xì)胞burst firing。同時(shí),借助AAV介導(dǎo)的基因干擾(RNAi)技術(shù),在小腦注射AAV9-shCK2敲減小腦浦肯野細(xì)胞中CK2可有效改善浦肯野細(xì)胞的不規(guī)則放電及小鼠運(yùn)動(dòng)性發(fā)作。
?
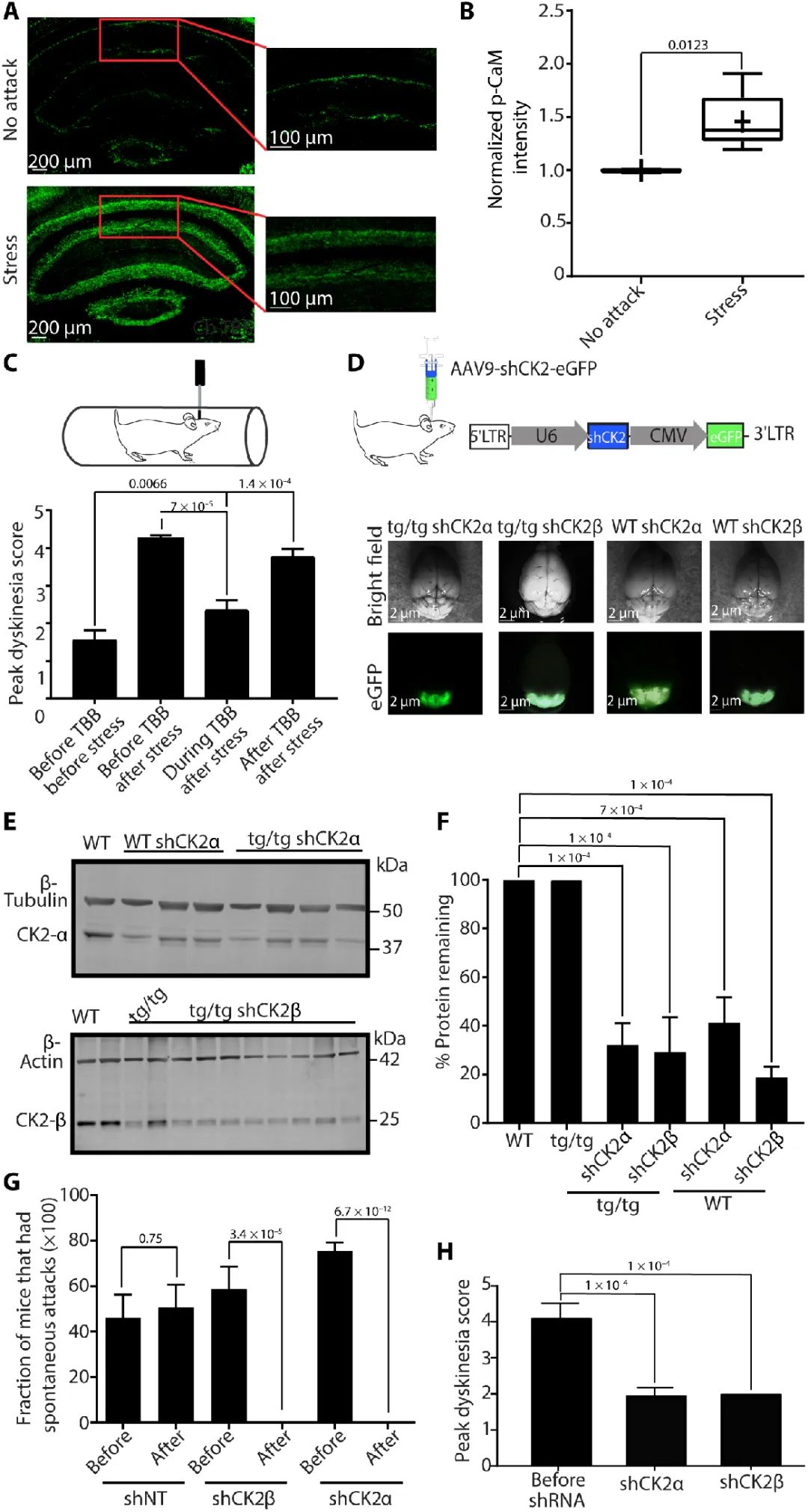
降低小腦CK2的表達(dá)可有效改善由應(yīng)激誘發(fā)的運(yùn)動(dòng)障礙
?
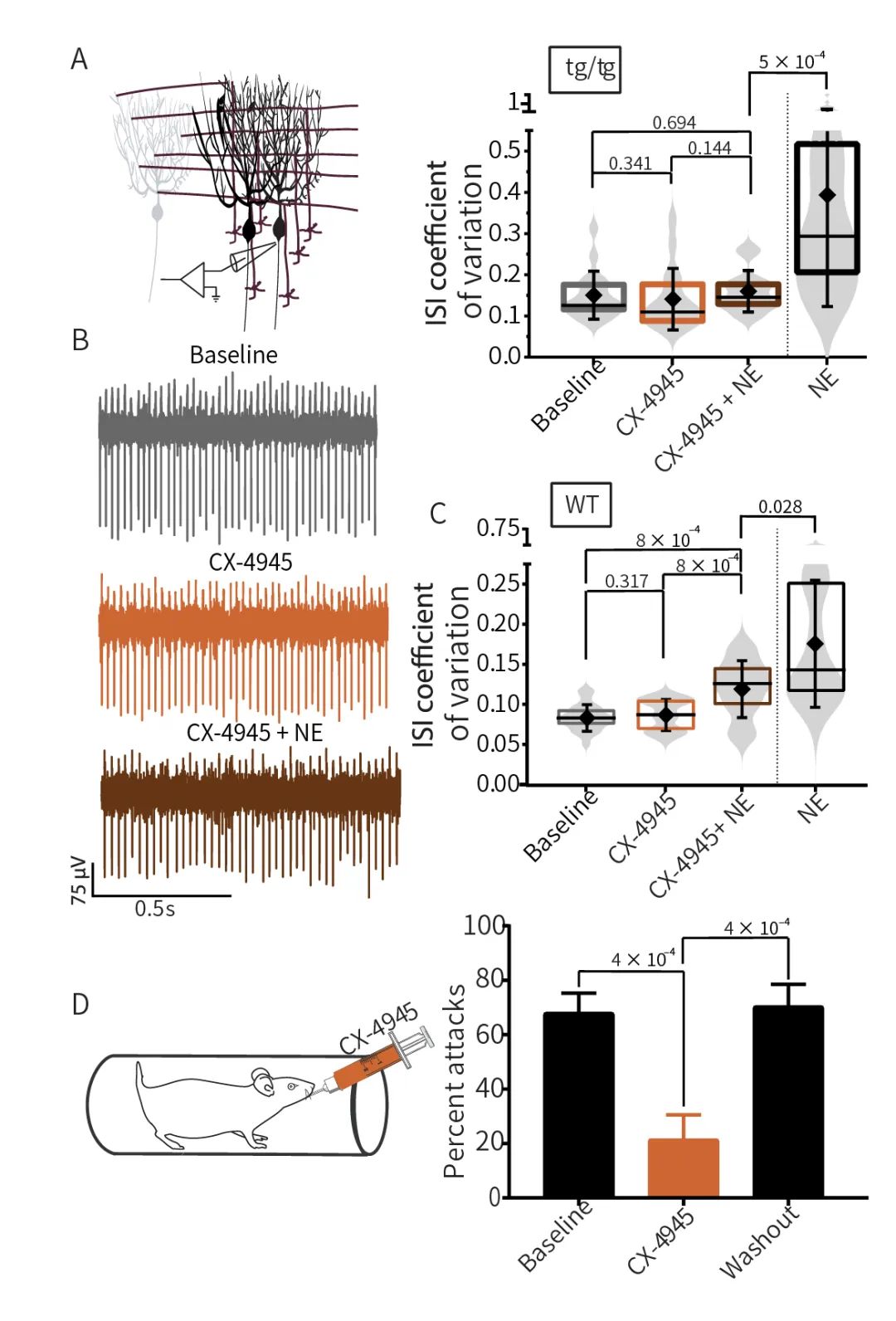
最后,研究團(tuán)隊(duì)基于FDA已批準(zhǔn)的高效的、有選擇性的CK2抑制劑CX-4945(silmitasertib)作用于Tottering小鼠,發(fā)現(xiàn)CX-4945可有效改善由NE誘導(dǎo)的浦肯野細(xì)胞異常放電。提示了CK2可作為EA2患者的潛在藥物靶點(diǎn)。
?
?
?
?
原文鏈接: https://www.science.org/doi/10.1126/sciadv.abh2675?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
?
