近幾年,單細胞技術無論在發展還是在需求上均呈現“井噴之勢”。因為傳統研究往往是針對大量細胞分析得到的平均結果,掩蓋了單個細胞的差異,無法捕捉單細胞層面更精細的變化。因此,在單細胞水平解析復雜多樣的細胞圖譜已經成為重要方向。尤其在癌癥、免疫、發育、進化等研究方向上,揭示細胞異質性變化已成為當下熱點和機遇。
目前,單細胞基因組和轉錄組技術已較為成熟,但蛋白層面發展非常有限。這是因為單個細胞的蛋白質一般不足200pg,且復雜程度更高,因此對質譜技術提出了更高的要求。總的來說,利用質譜進行單細胞水平蛋白質組分析主要面臨著三大挑戰:1)有效的將肽段傳輸到質譜檢測器中;2)肽段序列的鑒定;3)提高檢測通量。
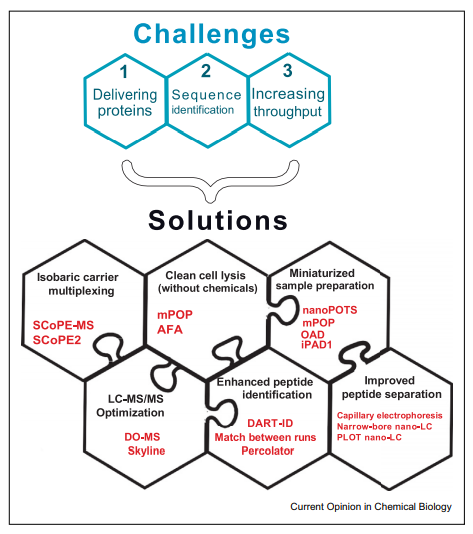
針對單細胞蛋白質組面臨的挑戰,來自美國東北大學的Nikolai Slavov團隊自主研發了SCoPE-MS及SCoPE2技術,并在“Single-cell protein analysis by mass spectrometry”中進行了詳細闡述,該技術優化了6大解決方案,再次提升蛋白質組鑒定能力,使得單細胞蛋白質組之夢咫尺可及,為細胞異質性研究的突破帶來無限可能。
?
Solution 1
SCoPE-MS引入了一個同位素載體的概念,利用TMT標記低豐度的目標樣本以及一個相對高豐度的載體樣本,混合后上機檢測。TMT標記使得單細胞的肽段序列和和bulk樣本具體相同的質荷比,碎裂后通過報告離子進行相對定量。這種方式有三個優點:一、吸附損失會按比例主要影響載體樣本,從而減少微量樣本的損失;二、載體蛋白組可以提供肽段碎片,從而可以提高肽段序列鑒定能力;三、TMT可以同時檢測多個樣本,提高檢測通量。
值得注意的是,由于載體只能減少損失和提高肽段序列的鑒定,而不能放大或提高信號離子的強度。因此,最重要的是將更多的肽段傳輸到質譜中,才能支撐起更可靠的定量分析。
?
Solution 2
常規的細胞裂解會使用去垢劑或其他一些化學試劑,不去除干凈會影響蛋白酶解和質譜分析。但去除化學試劑這個過程會損失樣本的同時,還會增加實驗流程的復雜性。自適應聚焦聲波(AFA)是一個天然的提取蛋白的方法,不會引入質譜不兼容的試劑,當然,要注意的是其要求樣本體積在10ul以上,且需較高的自動化設備成本。
?
Solution 3
前處理第二代方法——迷你蛋白質組學樣本準備儀(mPOP),利用的是冷凍-熱循環系統將蛋白傳輸至質譜系統,并將樣本體積減少了十倍且成本低廉。樣本體積的減少降低了試劑的使用量,也減小了試劑與樣本接觸的表面積,從而減少了樣本損失的可能性。
更進一步的,僅需要幾百納升的nanoPOTS、OAD,以及iPAD1的方法被發明了。SCoPE-MS就是采用了nanoPOTS。此時面臨的難點在于納升級別的樣本進樣需要手動操作。因此,想要充分利用微型細胞裂解和樣品制備需要進一步微型化所有其他分析步驟,包括高效且自動地將小樣品裝載到色譜柱上。
?
Solution 4
LC-MS/MS參數的優化可以提高鑒定到的肽段數以及定量的準確性,尤其是對于單細胞組學這樣的極微量的樣本,任何一點污染物或是離子傳輸過程的損失都會嚴重損害數據質量。作者團隊開發了優化LC-MS/MS參數的模塊化和交互式工具DO-MS。DO-MS通過對肽段分離和掃描,到譜圖匹配等各個階段的數據進行交互式可視化來診斷分析中的問題,是SCoPE2的一個主要組成部分。其一大優勢在于可以顯示肽段洗脫時距離峰值的時間偏移以及肽段進入二級質譜分析的時間。這些數據可以使得我們可以合理的糾正系統性誤差,選擇最佳的質譜參數,從而最大化進入串聯質譜分析的肽的比例或者能夠盡量使提取的位置接近肽的峰值。
?
Solution 5
肽段的豐度可以基于單個質荷比的峰計算,但是序列的確定則需要多個片段離子。因此低豐度的肽段容易定量,但序列的鑒定卻很難。為了克服這個困難,通常會用到所有特征性的信息對數據進行過濾,比如肽段的保留時間和離子淌度。但數據過濾的方法也是無法改善假陽性率的,于是研究團隊將貝葉斯框架和保留時間結合在一起,開發了一種數據驅動的校準保留時間的方法(DART-ID)。該方法在FDR設定為1%的條件下,將識別到的肽段的數量提升了50%。
?
Solution 6 優化質譜參數,提高肽段的分離度
尖銳的洗脫峰和低流速可以盡可能多的將肽段傳輸至質譜檢測器,這可以通過毛細管電泳、高靈敏度的多為色譜策略,以及使用整體的納米毛細管色譜柱,PLOT色譜柱、小孔徑的色譜柱,還有降低流速等實現。
?
中科新生命
單細胞蛋白質組技術使得蛋白質組學進入了一個極微量樣本的時代,可以應用于稀有細胞、處于不同分化階段的細胞或誘導分化的細胞分析,對于組織亞結構研究、胚胎發育、腫瘤異質性、CTC細胞、干細胞分化和神經研究等提供重要的生物學意義。中科新生命緊跟技術前沿,即將推出單細胞蛋白質組學服務,敬請期待!
