
胰腺導管腺癌(PDAC)的發病率在世界范圍內不斷上升,大多數患者在最初診斷時處于無法切除的狀態。當前,適用于臨床的循環PDAC生物標志物是糖類抗原19-9(CA19-9),由于診斷標志物的靈敏度和特異性不足,主要用于患者隨訪期間;因此,開發PDAC替代的分子診斷生物標志物的需求亟需解決。新的研究結果表明,腫瘤來源的外泌體內容物,特別是miRNAs,為癌癥特異性生物標志物的開發提供了一個極具吸引力的平臺。
2022年11月,Gastroenterology(IF 29.4)上發表了一篇題為“An Exosome-based Transcriptomic Signature for Noninvasive, Early Detection of Patients With Pancreatic Ductal Adenocarcinoma: A Multicenter Cohort Study”的多中心隊列研究文章,該研究發現血漿中13個miRNA組成的Panel(5個cf-miRNA和8個exo-miRNA)可用于PDAC患者進行無創和穩健的檢測,具有非常高的診斷性能。

研究材料
血漿和外泌體樣本,發現集(n=101,44例早期PDAC患者和57例非疾病對照),訓練集(n=96,62例早期PDAC患者和34例非疾病對照),驗證集(n=95,62例早期PDAC患者和33例非疾病對照)
技術路線
步驟1:發現隊列開展small RNA測序篩選差異miRNA,作為潛在的生物標志物;
步驟2:qRT-PCR對訓練隊列進行候選生物標志物檢測及訓練;
步驟3:qRT-PCR對驗證隊列進行候選生物標志物驗證;
步驟4:優化miRNA Panel,開發一種臨床可行且具有成本效益的檢測方法;
步驟5:優化miRNA Panel聯合血液中的CA19-9檢測顯著提高了PDAC的診斷準確性。
研究結果
1. 篩選差異miRNA,作為潛在的生物標志物為了識別臨床相關的循環miRNAs(cf-miRNAs)和外泌體miRNAs(exo-miRNAs)作為診斷PDAC患者的生物標志物,對早期PDAC(I期和II期)和非疾病對照患者的血漿樣本和外泌體RNA樣本進行了small RNA測序。通過差異miRNA的篩選(AUC值>0.7&|log2FC|>1,exo-miRNAs,AUC值>0.8&|log2FC|>1),鑒定出13個cf-miRNA和17個exo-miRNA作為潛在的生物標志物,這些miRNAs在I/II期PDAC患者中與非疾病對照組相比都顯著上調(圖1A和圖1B)。并通過邏輯回歸模型發現cf-miRNAs panel和exo-miRNAs panel相比于單個miRNA具有更好的診斷潛力。

圖1 早期PDAC患者血漿和外泌體候選miRNA的表達水平
2. 使用qRT-PCR對候選生物標志物進行檢測及訓練
對從訓練集患者獲得的血液樣本進行qRT-PCR的測定驗證潛在的生物標志物,發現9個cf-miRNA和15個exo-miRNA在PDAC患者中顯著上調。24個候選miRNA生物標志物隨后被納入邏輯回歸分析,用于構建訓練風險預測模型,以在訓練集隊列中識別PDAC患者。通過邏輯回歸模型結果發現9個cf-miRNA Panel的AUC值為0.90(靈敏度為73%,特異性為94%),15個exo-miRNA Panel的AUC為0.97(靈敏度為87%,特異性為94%),exo-miRNA Panel聯合cf-miRNA Panel的性能顯著增強,AUC為0.98(靈敏度為94%,特異性為97%)。再次指出,聯合Panel明顯優于單個標記。
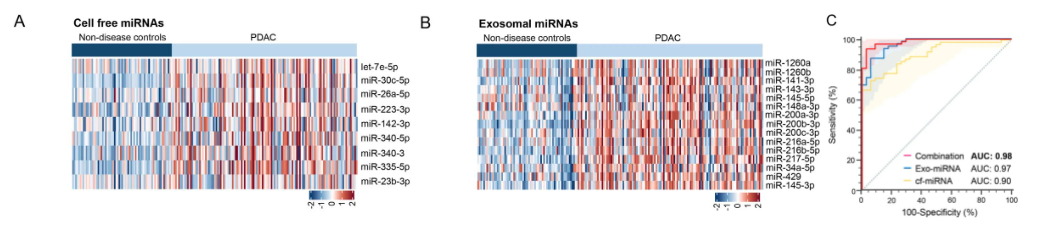
圖2 對訓練隊列中潛在的miRNA生物標志物的性能評估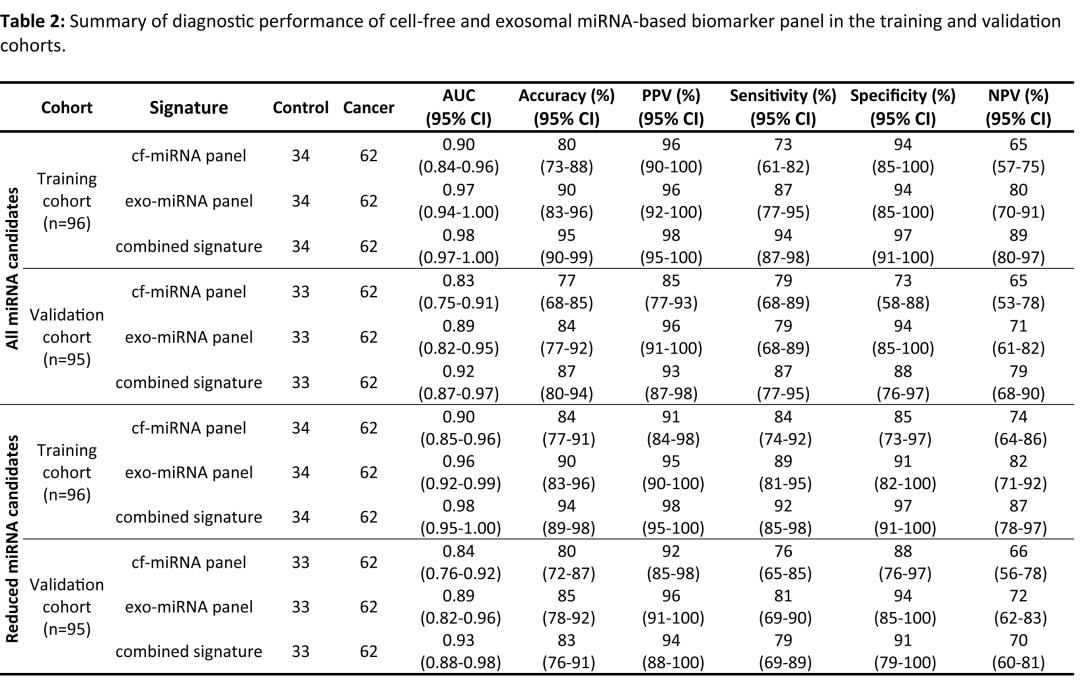
3. 使用qRT-PCR對候選生物標志物進行驗證
接下來,通過在血漿標本中進行qRT-PCR的檢測,在獨立驗證隊列中驗證miRNA檢測的診斷潛力。結果發現cf-miRNA Panel(AUC=0.83,敏感性=79%,特異性=73%)和exo-miRNA Panel(AUC=0.89,敏感性=79%,特異性=94%;圖3)在PDAC患者和對照組中表現優越。與訓練隊列的情況一樣,聯合cf-和exo miRNA Panel表現出更優越的診斷性能(AUC值為0.92,敏感性為87%,特異性為88%)。
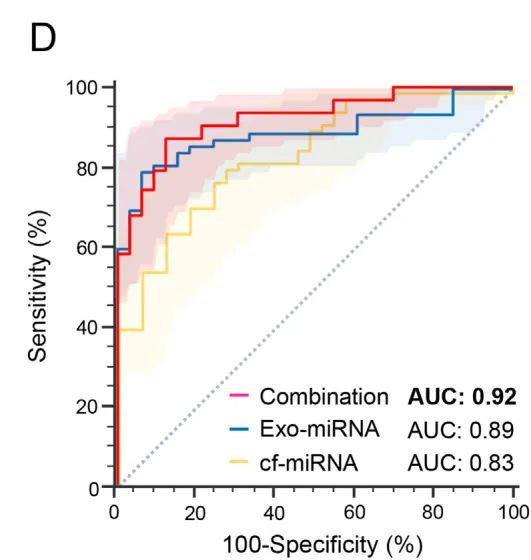
圖3 獨立驗證隊列中驗證miRNA檢測的診斷潛力
4. 優化miRNA Panel,用于PDAC患者的無創識別
為了開發一種臨床可行且具有成本效益的檢測方法,使用向后選擇法對候選miRNA生物標志物進行進一步選擇,在減少panel中標志物數量的同時,又保證整體診斷性能。通過該方法共保留13個miRNA(包括5個cf-miRNAs,8個exo-miRNA)。接下來,對這13個miRNA構建邏輯回歸模型,觀察到在訓練隊列中,cf-miRNA和exo-miRNA Panel AUC值分別為0.90和0.96,聯合cf-和exo miRNA Panel AUC值為0.98(圖4A)。同樣,將來自訓練隊列的風險預測模型應用于獨立的臨床驗證隊列,觀察到聯合Panel提供了更優越的診斷性能,AUC值為0.93(cf-miRNA Panel的AUC值0.84,exo miRNA Panel的AUC值為0.89,圖4B)。

圖4 優化miRNA Panel整體診斷性能評估
5. 優化的miRNA Panel聯合血液中的CA19-9顯著提高了對PDAC的診斷準確性
在常規臨床實踐中,CA19-9是可用于PDAC患者診斷的血液生物標志物;然而,它缺乏在普通人群中早期檢測所需的敏感性和特異性。因此,本研究將優化的miRNA Panel與CA19-9結合起來,以進一步提高臨床診斷性能。結果發現,在PDAC的所有階段CA19-9的AUC值為0.88,但當將CA19-9與優化的miRNA Panel相結合時,總體診斷性能顯著改善,AUC值為0.99(圖5A)。值得注意的是,即使在I和II期病變的早期PDAC患者中,這種聯合診斷性能也同樣顯著提升(CA19-9的AUC值為0.86,優化的miRNA Panel與CA19-9聯合AUC值為0.99,圖5B)。

圖6 優化的miRNA Panel在PDAC假陰性患者中的診斷性能評估
文章小結
本研究對來自早期PDAC患者(I/II期)和非疾病對照受試者進行了血漿和外泌體的small RNA測序,確定cf-miRNA和exo-miRNA特征,并估其對PDAC患者早期檢測的診斷性能,發現了13個miRNA組成的Panel(8個exo-miRNA和5個cf-miRNA)可用于PDAC患者早期檢測,為基于外泌體的轉錄組標記用于無創、液體活檢檢測用于胰腺導管腺癌患者的臨床意義提供了有希望的證據。