RAS蛋白是癌癥中常見的突變蛋白,但其作為藥物靶點在很大程度上仍未被充分開發利用。2025年8月29日,中國科學院大學周琪院士、李偉研究員、滕飛博士在Trends in Biotechnology (IF 14.9)上發表了題為“Targeting RAS-mutant cancer cells using a synthetic RAS-activated cancer killing system”的研究論文,研究報告了一個合成的癌癥殺傷平臺,稱為" RAS激活的癌癥殺傷( RACK ) "系統,可以實現RAS-突變癌癥細胞的靶向識別和消除。RACK系統開創了一種突破性的治療策略,能夠同步實現RAS突變癌細胞的檢測與清除,為攻克目前"不可成藥"癌癥靶點的治療難題開辟了新途徑。
· 維真助力 - AAV·
病毒產品 AAV-DJ-PA1S2-HSV-TK-pA 、AAV-DJ-PA1S2-nLuc-pA
實驗動物 5-8周齡BALB/c裸鼠(兩側腹部注射5 ×106個癌細胞)
注射方式 瘤內給藥,2天后再次注射
病毒用量 5×1011vg/100mm3腫瘤體積
01研究結果分享
1、轉錄組指導設計特異性感知致癌RAS信號的轉錄傳感器
研究人員分析了十個不同的KRAS突變癌癥隊列的轉錄組數據,鑒定發現16個內源性基因在這些原發性腫瘤中持續上調。進一步分析發現,KRAS突變可上調部分轉錄因子及其結合基序,其中激活蛋白1(AP-1)和血清反應因子(SRF)的結合基序占比最高,這與二者在KRAS依賴型腫瘤發生中的關鍵作用相符,并進一步通過實驗驗證了AP1反應元件(AP1_REs)和SRF反應元件(SRF_REs)為主要元件。基于這些發現,研究團隊設計了一系列RAS轉錄傳感器:將最小核心啟動子與包含多個SRF_REs或AP1_REs的合成上游調控區結合,使其可被RAS下游轉錄因子選擇性激活。同時,為降低背景信號,采用兩種低泄漏最小啟動子(命名為P1和P2)構建轉錄傳感器。通過納米熒光素酶(nLuc)報告基因檢測傳感器的響應性,結果證實這些工程化轉錄傳感器能特異性感知并區分致癌KRAS信號與正常KRAS信號,比較后發現P1的背景信號顯著低于P2,因此后續選擇P1作為核心啟動子。結合已有研究,設計了兩個協同啟動子(PA1S2_v1和PS2A1_v1),它們包含AP1_REs、SRF_REs和P1,可以顯著增強KRASmut細胞的激活。
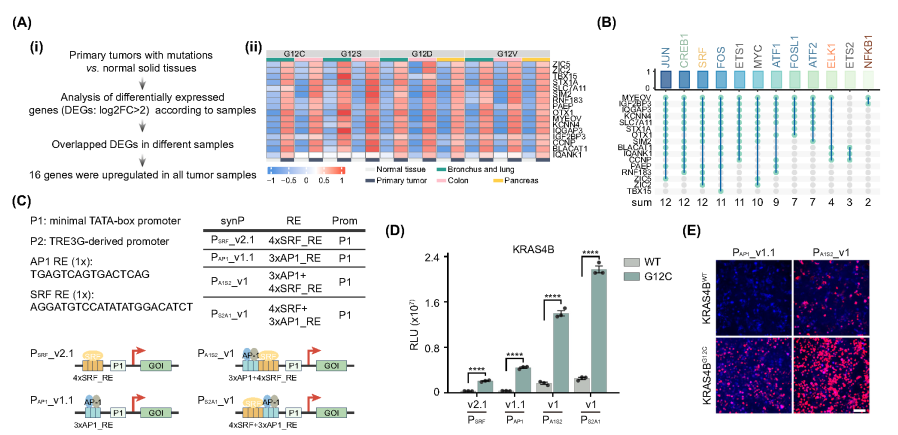
圖1. 轉錄組學指導轉錄傳感器的設計,以檢測致癌KRAS信號
2、RACK系統在體外選擇性消融RASG12C細胞
為了開發用于根除癌癥細胞的RACK系統,將HSV-TK基因直接定位在合成轉錄傳感器的下游,導致HSV-TK酶在RASmut細胞中特異性表達增強,隨后將前藥GCV轉化為細胞毒性產物。研究人員首先在人類細胞系中驗證了攜帶不同啟動子的RACK構建體的功效,發現兩種RACK構建體在給予GCV后均能有效誘導過表達KRASG12C的HEK293T細胞死亡,而PA1S2驅動的RACK系統清除癌細胞的效果優于PAP1驅動的系統。為證實RACK在KRASmut癌癥細胞中的抗癌特異性,使用RACK轉染過表達KRAS的HEK293T細胞,并證明RACK促進了KRASG12C過表達的HEK293T細胞的特異性消融,過表達KRASWT的HEK293T細胞不受治療的影響。采用癌癥共培養模型來評估RACK的高選擇性抗癌活性,在該模型中,用RACK(lenti-PA1S2-HSV-TK-pA)處理包含NCI-H23EGFP和HeLamTagBFP2細胞的共培養物。正如預期的那樣,RACK選擇性地殺死了KRASG12C NCI-H23細胞,但保留了KRASWT HeLa細胞,進一步證實了RACK對KRAS活躍細胞的特異性。
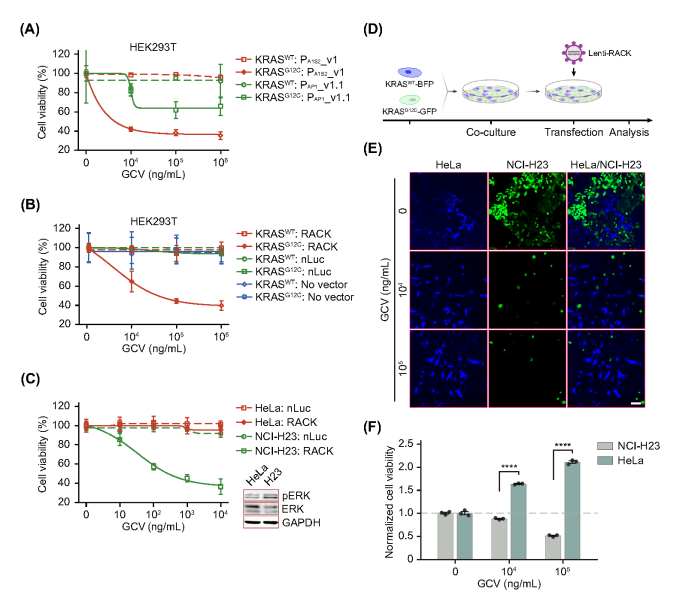
圖2.RACK有效且選擇性地消融KRASG12C細胞
3、RACK在體內抑制腫瘤的廣譜活性
研究人員在7種不同的癌細胞系中驗證了RACK的普適性,RACK系統不僅能靶向攜帶不同遺傳背景的癌細胞,還能作用于產生獲得性耐藥的癌細胞。為了評估RACK是否也可以在體內實現抗腫瘤作用,進一步使用了異種移植物實體瘤模型,將表達RACK的人源腫瘤細胞移植到小鼠皮下形成腫瘤。當給小鼠注射GCV后,可以觀察到攜帶KRASG12C,KRASG12V,NRASQ61K突變的腫瘤體積顯著縮小,而作為對照的正常腫瘤則繼續生長,突顯了RACK在抑制體內腫瘤生長方面的強大功效。接下來,研究了通過AAV遞送RACK對已建立RASmut腫瘤的動物的治療作用,將NRASQ61K細胞(NCI-H1299)或RASWT(HeLa)細胞移植到BALB/c裸鼠的腹部兩側。腫瘤生長后,將編碼RACK的AAV(AAV-DJ-PA1S2-HSV-TK-pA)和對照構建體(AAV-DJ-2-PA1S2-nLuc-pA)分別注射至同一實驗動物兩側移植瘤內,此操作重復兩次,后續按隔日方案給予GCV治療。結果表明,與對照組相比,RACK/GCV治療后致癌RAS腫瘤顯著消退,展示了基于RACK的基因治療的療效。此外,接受治療的小鼠沒有表現出明顯的治療后副作用。這些數據表明,RACK的體內遞送有可能引發抗腫瘤作用。
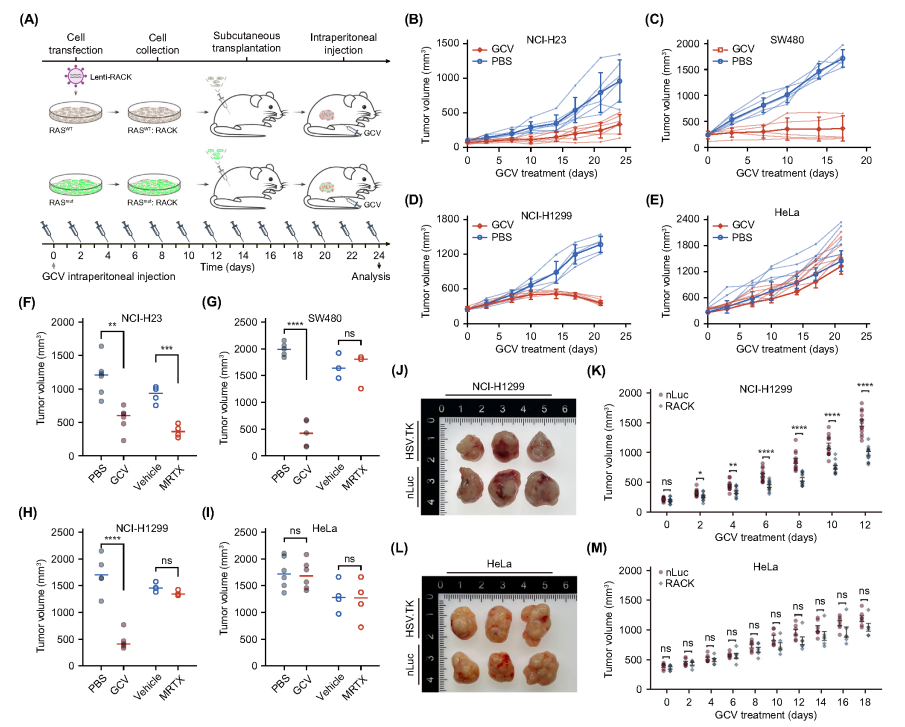
圖3.RACK在體內抑制腫瘤的強大和廣譜活性
02結論
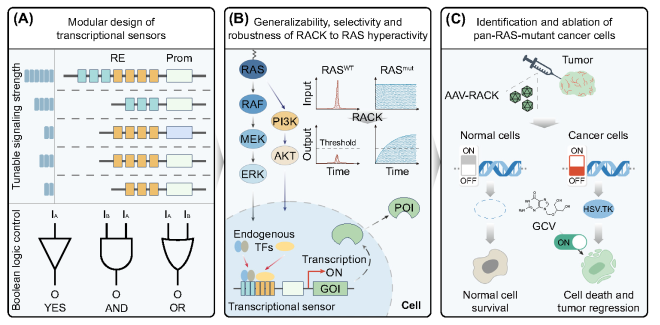
本研究開發的RAS激活的癌癥殺傷系統RACK基于合成回路,為癌細胞識別和消融提供了一種新的方法。在該系統中,通過工程化的轉錄傳感器檢測特定的致癌信號,從而驅動治療反應的激活,RACK系統將為癌癥治療提供可行的策略。
