IF=13.2|密歇根州立大學研究團隊:蛋白冠+AI解碼心臟腫瘤雙重標志物,CCT7與TBXAS1點亮共病診療新路徑


英文標題:AI-driven prediction of cardio-oncology biomarkers through protein corona analysis
中文標題:通過蛋白冠分析實現心臟腫瘤生物標志物的人工智能驅動預測
發表期刊:Chemical Engineering Journal
影響因子:13.2
研究背景
在心臟腫瘤學領域,前列腺癌(PC)作為美國男性最常見的惡性腫瘤,其轉移性(mPC)會導致患者五年生存率從局限性疾病的99%驟降至不足60%,嚴重威脅患者生命。同時,動脈粥樣硬化性心血管疾病(ASCVD)與PC的進展存在密切關聯,可通過多種循環因子加劇腫瘤侵襲性和轉移擴散,但二者相互作用的具體機制尚未明確。
傳統診斷手段如前列腺特異性抗原(PSA)篩查缺乏特異性,而血漿蛋白組學雖為生物標志物發現的首選方法,卻受限于血漿蛋白質組的高復雜性和寬動態范圍,難以檢測低豐度關鍵蛋白,導致高風險患者的早期診斷和干預滯后。
蛋白質冠作為納米顆粒表面形成的蛋白質層,能富集傳統血漿分析中難以捕捉的低豐度蛋白,顯著降低樣本復雜性,且其組成可反映健康與疾病狀態下的血漿特征,為解決上述挑戰提供了新思路。基于此,本研究整合蛋白質冠分析、質譜技術、機器學習與因果推理,旨在揭示ASCVD與mPC的潛在關聯生物標志物及機制。
技術路線
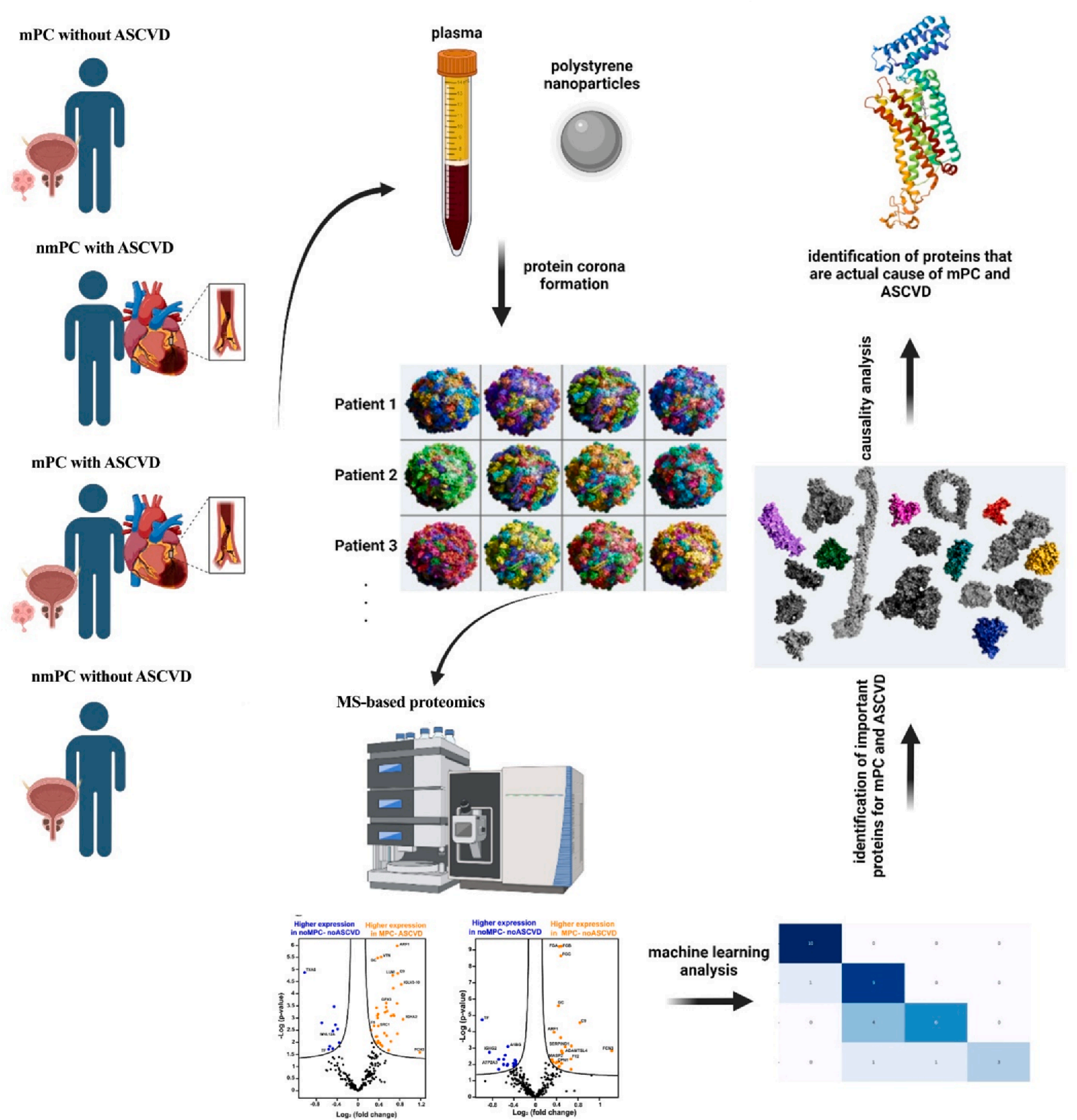
圖1. 納米醫學平臺示意圖
研究結果
1、研究方法與策略
本研究的血漿樣本來源于2024年4月就診于奧古斯塔大學癌癥中心的前列腺癌(PC)患者,圖1所呈現的納米醫學平臺清晰展現了整體檢測流程,該平臺整合了蛋白冠分析、機器學習算法及實際因果關系評估等關鍵環節。研究將受試者劃分為四組:(1)mPC合并ASCVD組,即患有轉移性前列腺癌同時伴有動脈粥樣硬化性心血管疾病;(2)ASCVD合并nmPC組,指患有心血管疾病且同時存在非轉移性前列腺癌;(3)單純mPC組,為僅患有轉移性前列腺癌而無心血管疾病;(4)nmPC不合并ASCVD組,為非轉移性前列腺癌且不合并動脈粥樣硬化性心血管疾病。
各組收集的血漿樣本與聚苯乙烯納米顆粒共同孵育后,納米顆粒表面會形成蛋白冠,隨后通過質譜分析和機器學習,篩選出與mPC和ASCVD相關的重要蛋白標志物。
基于質譜的自下而上蛋白質組學(BUP)工作流程可參考圖2,該研究共收集了35名PC患者的血漿樣本,并按上述方式完成分組。結果顯示,57.1%的人群患有高脂血癥,且這一情況與亞組分布存在顯著相關性。
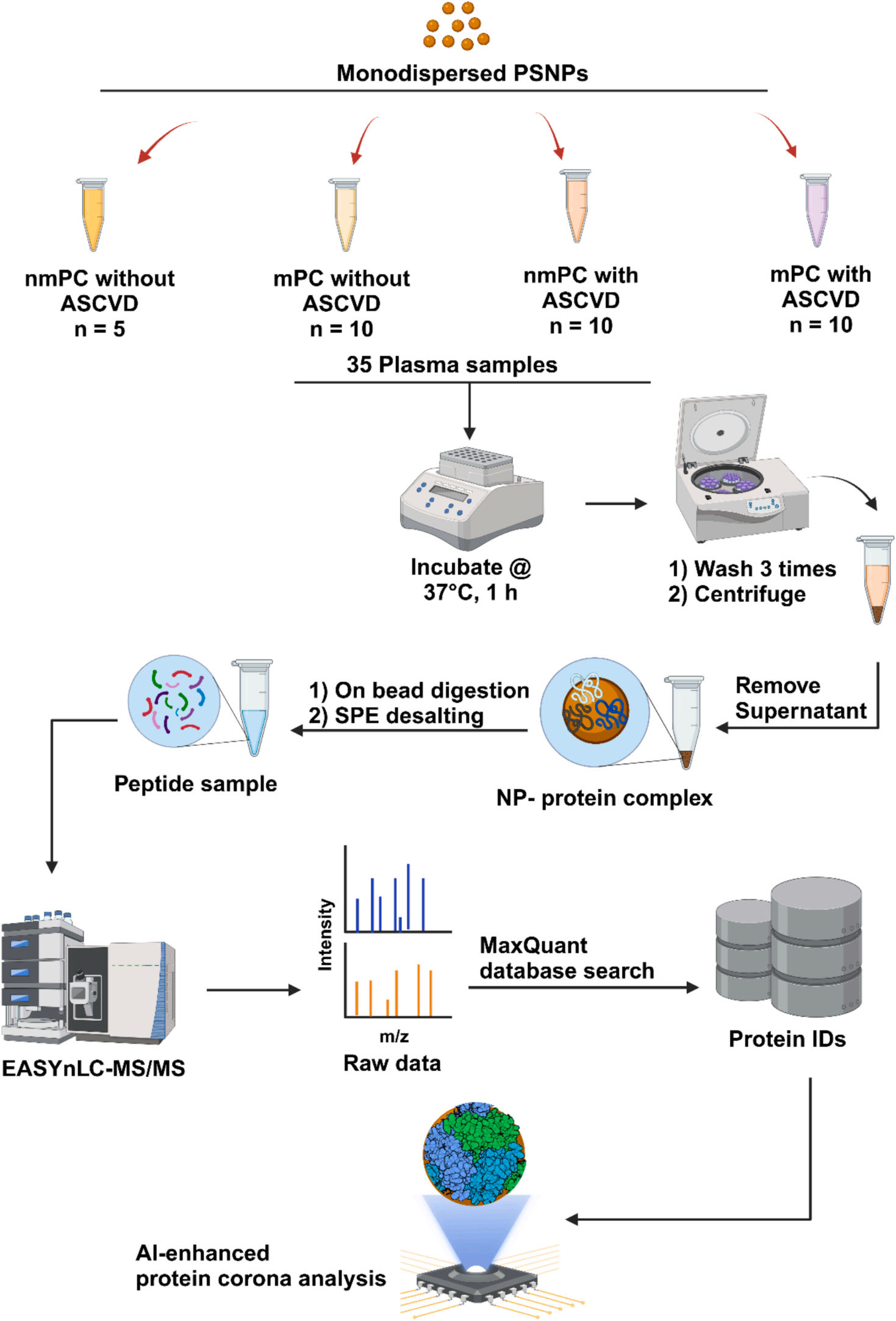
圖2. 基于質譜的自下而上蛋白質組學(BUP)工作流程示意圖
2、蛋白冠分析
動態光散射(DLS)與zeta電位測定結果顯示,相較于原始納米顆粒(NPs),經處理后的納米顆粒在粒徑和表面電荷上均顯著增加(圖3A-B),這一變化明確證實了蛋白冠的成功形成。透射電鏡(TEM)分析進一步直觀呈現了納米顆粒表面包裹的蛋白冠層(圖3A)。
基于質譜的自下而上蛋白質組學(BUP)分析對四組患者的血漿樣本進行了蛋白冠組分解析,每組樣本均設置三重重復實驗,以確保數據的可靠性與重現性(圖3C-D)。通過該分析,共鑒定出887種獨特蛋白質,其中260種蛋白質在所有樣本中穩定檢出。
火山圖分析(圖3C)揭示了這260種共有蛋白質在不同患者組間的表達差異。結合基因本體論(GO)分析(圖3D)對這些蛋白質進行深入分類后,發現了關鍵通路的富集趨勢:與單純mPC患者相比,mPC合并ASCVD患者的蛋白冠中,補體激活、纖維蛋白溶解、血液凝固、先天免疫應答及Arp2/3復合體介導的肌動蛋白成核通路顯著富集;此外,GABA能突觸、肌母細胞增殖、G蛋白偶聯乙酰膽堿受體信號傳導、通用信號轉導及Rap1信號通路也呈現特異性上調。
通過對四組樣本蛋白冠的血漿蛋白質組特征分析(圖3),研究揭示這些通路可通過促進慢性炎癥、細胞增殖、血管重構及細胞運動性,共同為動脈粥樣硬化中的斑塊形成與不穩定、癌癥中的腫瘤生長、存活及轉移創造有利條件。
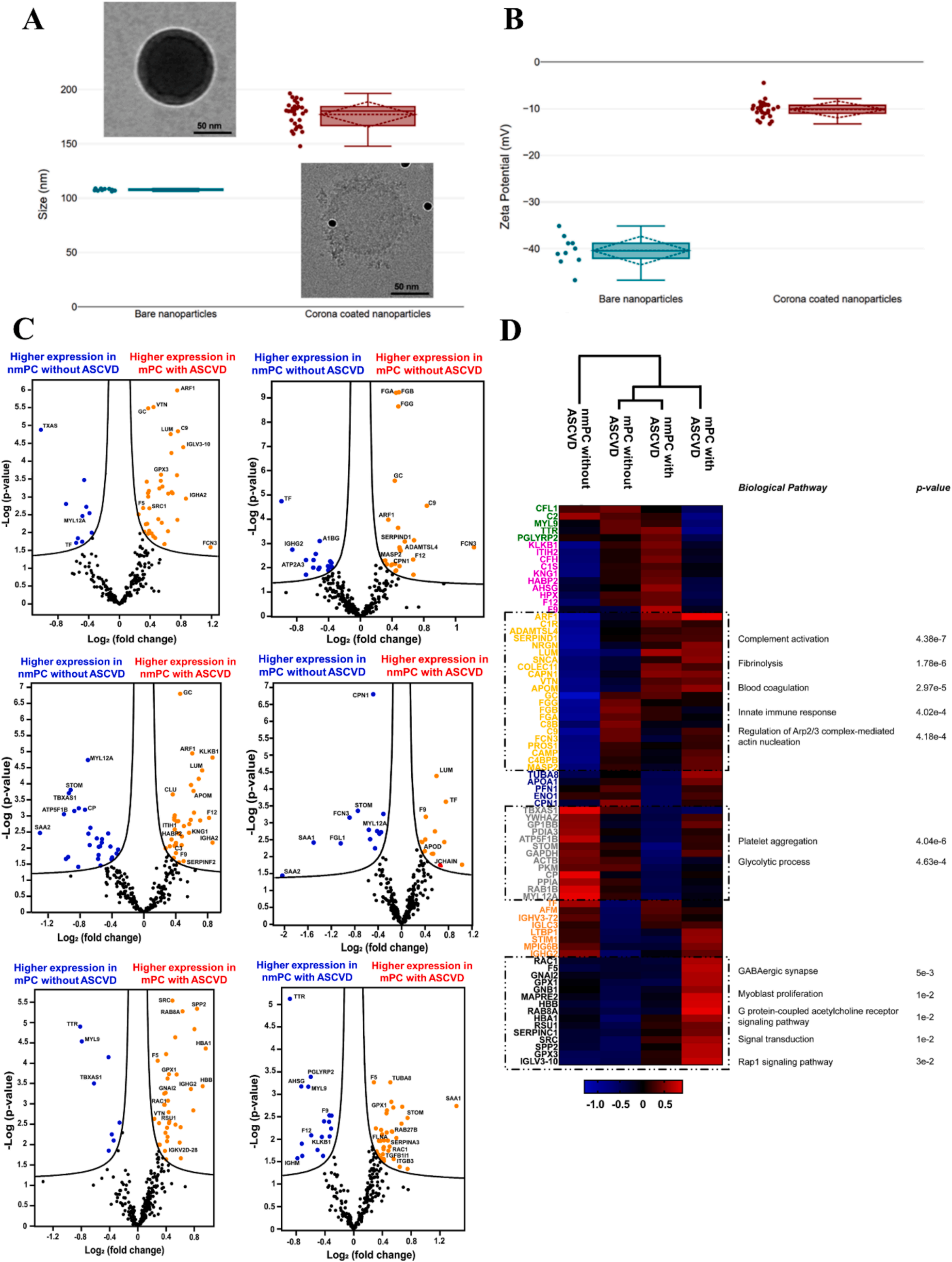
圖3. 蛋白冠表征及蛋白質組學分析總結
3、AI-機器學習
基于上述蛋白質組學數據,研究應用AI機器學習方法篩選可穩定區分mPC與ASCVD分組的核心蛋白,采用LASSO正則化(L1正則化)構建邏輯回歸模型處理高維度蛋白特征數據。通過網格搜索確定最優正則化系數,在保持驗證集分類準確率≥80%的同時最小化非零系數數量,以此降低過擬合風險并精準鎖定與mPC/ASCVD分類目標最相關的蛋白子集。
圖4A(四組分類混淆矩陣)顯示了選定蛋白的分類性能,各組差異蛋白包括:①mPC合并ASCVD組:肌球蛋白輕鏈3、凝血因子V、甲狀腺素運載蛋白、CCT7、肌球蛋白調節輕鏈多肽9、真核翻譯起始因子5A-1、TBXAS1;②ASCVD合并nmPC組:Stomatin蛋白;③單純mPC組:PRKG1;④單純nmPC組:淋巴細胞抗原6復合體G6f蛋白、CCT7、Ras相關蛋白Rab-1A等。結合圖4B(ASCVD分類混淆矩陣)和圖4C(轉移分類混淆矩陣)對蛋白與疾病及共病狀態的關聯分析,共鑒定出22種獨特蛋白質,其中ASCVD關聯蛋白12種(含CCT7、TBXAS1等),mPC轉移關聯蛋白11種(含CCT7等)。CCT7是22種蛋白中唯一的共病標志物,凸顯其作為心臟腫瘤學雙重生物標志物的潛力。
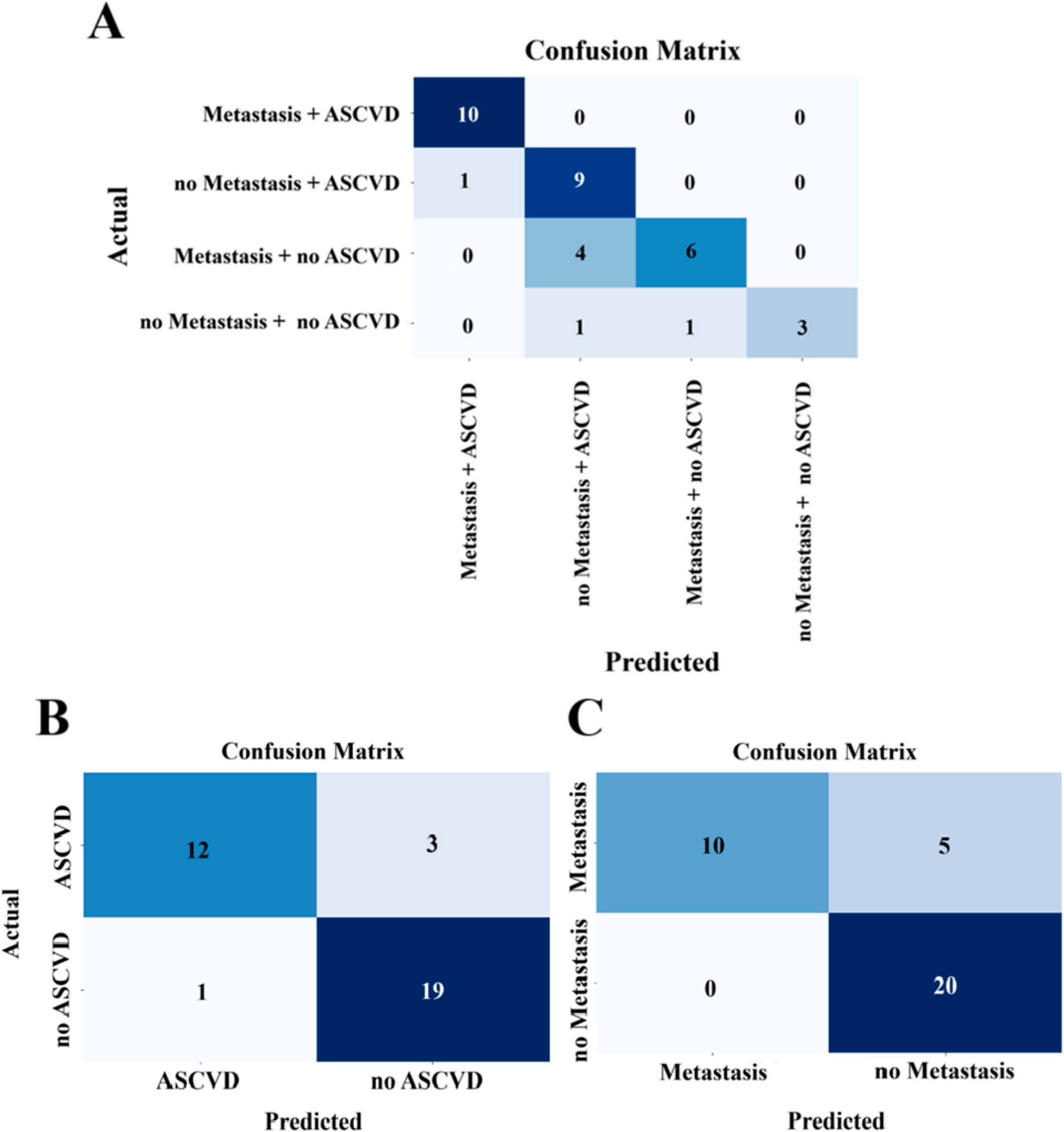
圖4. 蛋白質組學分類模型混淆矩陣結果
4、因果關系分析
在因果分析中,該研究初步篩查了全部887種鑒定蛋白,但因樣本量有限(僅35例),算法識別出400種潛在因果蛋白。鑒于實際因果蛋白常呈現相關性,該研究轉而聚焦機器學習篩選出的22種與ASCVD或mPC顯著關聯的蛋白。通過精煉因果分析,最終確定血栓素-A合酶1(TBXAS1)、肌動蛋白β及真核翻譯起始因子5A-1為ASCVD的實際誘因,其中TBXAS1同時被確定為mPC的因果蛋白。
機器學習篩選出疾病特異性蛋白標志物:肌球蛋白輕鏈3、凝血因子V、真核翻譯起始因子5A-1在mPC合并ASCVD患者中富集,提示其在肌肉收縮、凝血及免疫調節交叉通路中的作用;因果蛋白TBXAS1(僅在蛋白冠中可檢測,標準血漿proteomics中未檢出)通過促進血小板聚集、血管平滑肌細胞增殖等過程,連接血栓形成與腫瘤進展;而stomatin(ASCVD特異性)與PRKG1(mPC特異性)則體現了生物標志物的疾病背景依賴性。尤為關鍵的是,22種標志物中唯一同時與ASCVD和mPC相關的蛋白——伴侶蛋白含TCP1亞基7(CCT7),在前列腺腺癌細胞中的表達顯著高于早期前列腺腫瘤細胞(DepMap數據庫,圖5A),其通過調控腫瘤相關蛋白折疊,成為心臟腫瘤學中兼具診斷與治療價值的新型靶點。圖5B進一步驗證了TBXAS1的功能相關性,顯示其在轉移性前列腺腺癌中高表達,為預防癌癥轉移提供了潛在靶點。
研究揭示,CCT7通過調控炎癥反應和血管平滑肌細胞增殖驅動ASCVD進展,其雙重關聯特性為同時監測心血管疾病與癌癥提供了整合視角;因果分析確證的TBXAS1則通過蛋白冠技術被成功捕獲,其在血小板聚集和腫瘤-血管相互作用中的關鍵角色,使其成為ASCVD與mPC的共同治療靶標。
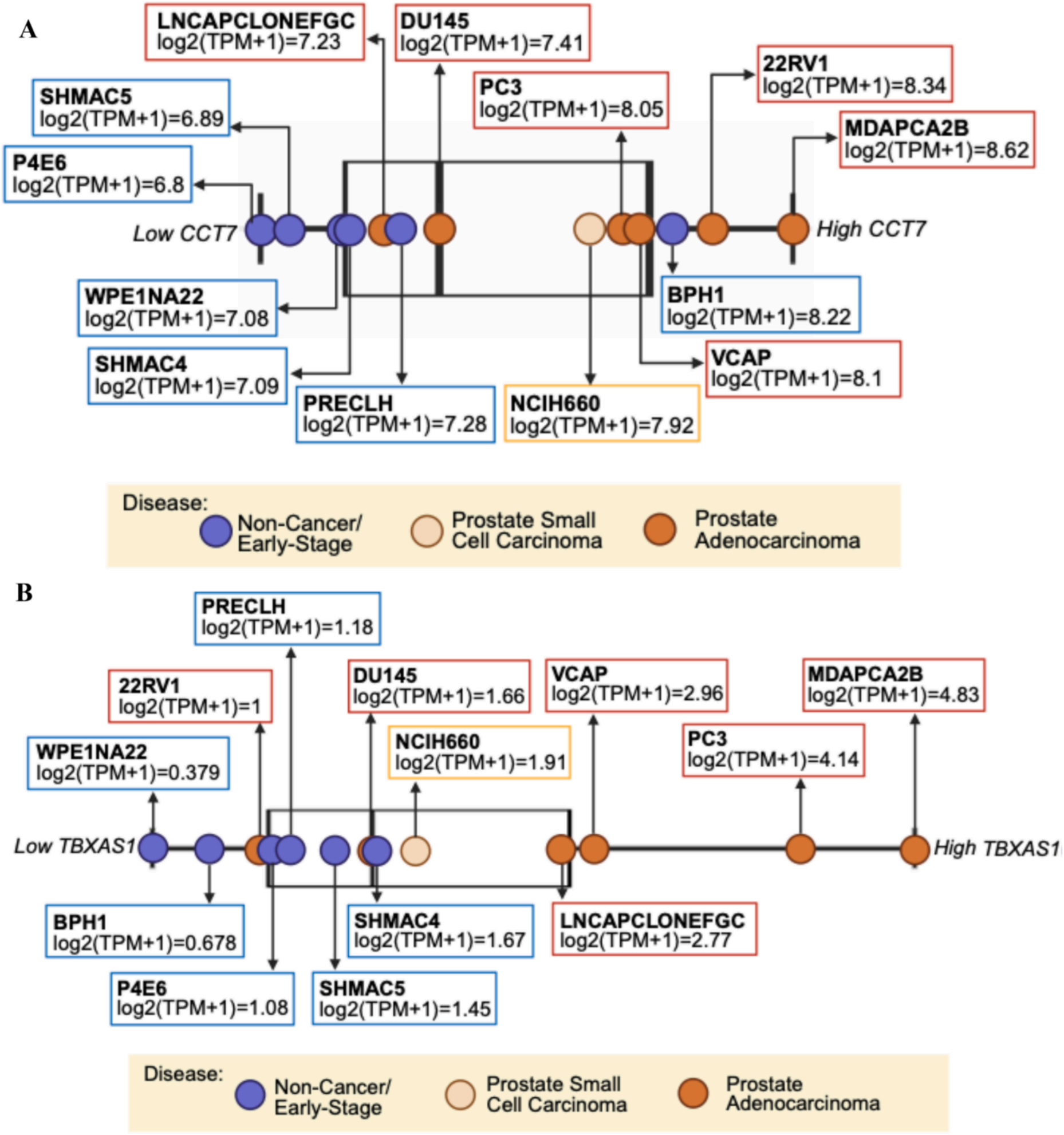
圖5. 與早期前列腺癌相比,在轉移性前列腺癌和前列腺小細胞癌來源的細胞中CCT7(A)和TBXAS1(B)表達水平更高
研究結論
該研究通過蛋白質組學分析結合AI機器學習方法,篩選出可穩定區分轉移性前列腺癌(mPC)與動脈粥樣硬化性心血管疾病(ASCVD)及其共病狀態的22種顯著關聯蛋白。因果分析進一步確定TBXAS1等為關鍵致病因子,其中TBXAS1同時參與兩種疾病的病理過程,而CCT7作為唯一雙病共有關聯蛋白,在轉移性前列腺腺癌細胞中高表達,通過調控腫瘤蛋白折疊及炎癥反應等機制,成為心臟腫瘤學領域潛在的新型診斷標志物與治療靶點。研究不僅揭示了mPC與ASCVD共病的分子關聯機制,更為兩病的精準診療提供了重要的蛋白標志物與靶標群。
百趣生物血液蛋白冠-DIA 1X,以納米材料表面修飾技術為核心支撐,通過納米顆粒與血清 / 血漿樣本的特異性共孵育反應,依托分子間特異性親和力實現低豐度蛋白的高效富集,進而形成蛋白冠結構。該技術整合樣本前處理自動化平臺,耦合高靈敏度Astral質譜系統,采用數據非依賴采集(DIA)模式,可實現血液樣本的深度蛋白質組學全景分析。相較于常規血液蛋白質組學檢測方案,該技術的核心優勢在于搭載自主研發的專利磁珠D1(已獲國家專利認證)。從磁珠的精密制備到標準化應用流程,均由專業設備與技術團隊全程質控,確保磁珠批次間穩定性與均一性。基于此,檢測數據呈現出卓越的質量特征:蛋白鑒定數量穩定突破5000+,蛋白穩定檢出率達80%以上,同時顯著提升功能性指標的檢出豐度,為血液蛋白質組學研究提供了高維度、高可靠性的技術解決方案。
若您“血液蛋白冠-DIA 1X”服務感興趣,百趣生物可提供專業技術服務,歡迎后臺私信咨詢!
END
hao 撰文
Winly 校稿
