隨著細(xì)胞治療領(lǐng)域的快速發(fā)展,In Vivo CAR-T(體內(nèi)CAR-T)療法成為行業(yè)新焦點。與傳統(tǒng)體外制備CAR-T不同,這項技術(shù)只需向患者體內(nèi)注射攜帶CAR基因的病毒載體,便能直接在體內(nèi)“就地”改造T細(xì)胞,大大簡化治療流程,為患者爭取寶貴時間。
2025年,In Vivo CAR-T領(lǐng)域捷報頻傳:阿斯利康以總價10億美元收購EsoBiotec,將其工程化納米抗體慢病毒平臺收入囊中;艾伯維則以高達(dá)21億美元全現(xiàn)金收購了專注于該領(lǐng)域的Capstan Therapeutics。
巨頭的巨額押注,凸顯了In Vivo CAR-T的巨大潛力。相比傳統(tǒng)體外CAR-T,其優(yōu)勢顯著:
擺脫復(fù)雜的個體化生產(chǎn)流程,患者無需經(jīng)歷細(xì)胞采集、體外改造、擴增回輸?shù)嚷L過程。
治療成本有望大幅下降,讓更多患者受益。
專家觀點:易慕峰生物研發(fā)中心負(fù)責(zé)人郝瑞棟博士指出:“我們的全新In Vivo技術(shù)平臺,成功打破了國外企業(yè)在關(guān)鍵元件上的專利壁壘。”
臨床層面,易慕峰基于慢病毒載體的平臺已在臨床前展現(xiàn)出出色性能。而EsoBiotec的ESO-T01作為第1個進(jìn)入人體試驗的體內(nèi)BCMA CAR-T候選藥物,在復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者中實現(xiàn)了100%的客觀緩解率,成果令人鼓舞。
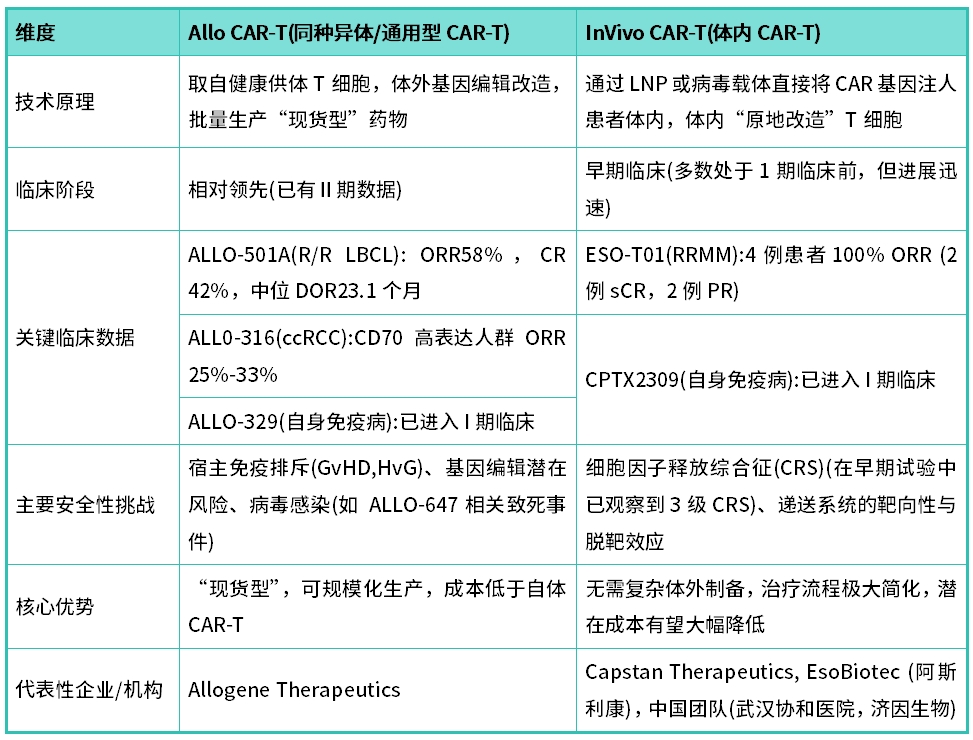
表1:In Vivo與Allo CAR-T核心特點與臨床進(jìn)展對比表
在In Vivo CAR-T開發(fā)中,遞送系統(tǒng)的選擇至關(guān)重要。目前,慢病毒載體因其可實現(xiàn)單次給藥、靶向性強、免疫原性低且臨床經(jīng)驗豐富,成為主流選擇。然而,傳統(tǒng)的慢病毒生產(chǎn)工藝面臨滴度波動大、成本高、批次一致性差等挑戰(zhàn),難以滿足體內(nèi)治療的大規(guī)模生產(chǎn)需求。
破解這一瓶頸的關(guān)鍵在于穩(wěn)定細(xì)胞系的開發(fā)。以深研生物的EuLV穩(wěn)轉(zhuǎn)細(xì)胞系生產(chǎn)系統(tǒng)為例,通過使用可誘導(dǎo)的穩(wěn)定生產(chǎn)細(xì)胞系,在化學(xué)成分確定的培養(yǎng)基中生產(chǎn),實現(xiàn)了病毒產(chǎn)量提升近百倍、生產(chǎn)成本降低80%的巨大飛躍,為產(chǎn)業(yè)化奠定了堅實基礎(chǔ)。
構(gòu)建包裝細(xì)胞系:將慢病毒包裝基因穩(wěn)定插入宿主細(xì)胞基因組。
插入目標(biāo)基因:將CAR基因穩(wěn)定插入包裝細(xì)胞系,篩選出高產(chǎn)、穩(wěn)定的單克隆。
規(guī)模化生產(chǎn):在化學(xué)成分限定培養(yǎng)基中進(jìn)行高密度懸浮培養(yǎng),誘導(dǎo)生產(chǎn)慢病毒載體。
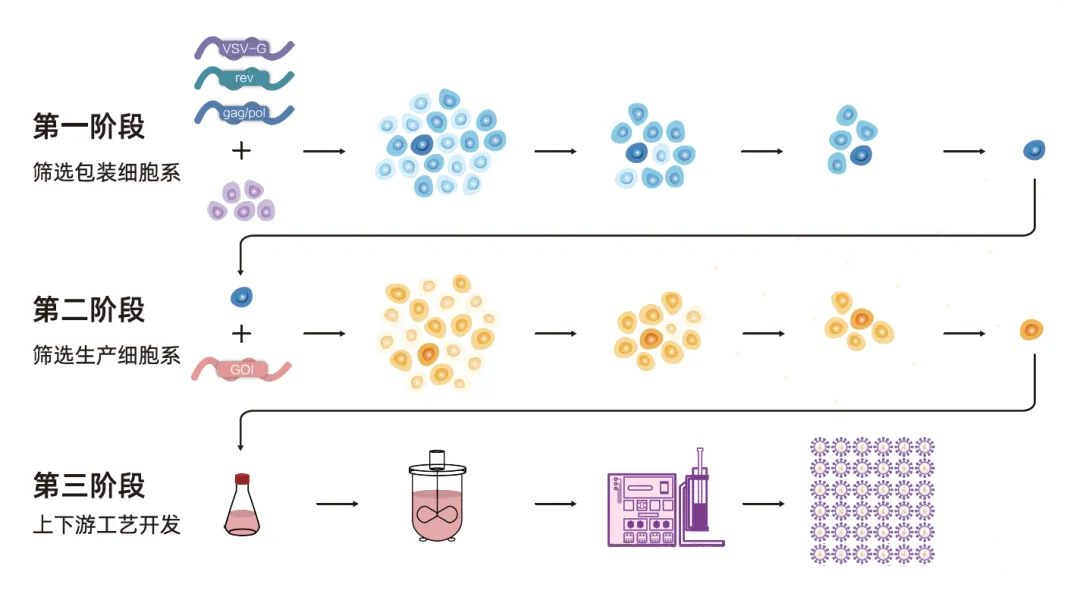
圖1:穩(wěn)轉(zhuǎn)細(xì)胞系構(gòu)建路線圖
在構(gòu)建穩(wěn)定細(xì)胞系的過程中,最關(guān)鍵的一步是篩選出高產(chǎn)、高穩(wěn)定性的單克隆細(xì)胞。而單細(xì)胞打印技術(shù)正是在這一環(huán)節(jié)發(fā)揮著“神助攻”的關(guān)鍵作用。
這項技術(shù)已在產(chǎn)業(yè)界得到成功驗證。例如,國際藥企葛蘭素史克(GSK)在其發(fā)表于《Molecular Therapy Methods & Clinical Development》(2020)的研究中,詳細(xì)闡述了如何利用Cytena單細(xì)胞打印機,高效構(gòu)建用于慢病毒載體生產(chǎn)的穩(wěn)轉(zhuǎn)細(xì)胞系。
該研究通過單細(xì)胞打印篩選出的高產(chǎn)單克隆,在搖瓶規(guī)模下生產(chǎn)的未濃縮慢病毒載體功能性滴度即可穩(wěn)定超過1×10? TU/mL,與高效瞬時轉(zhuǎn)染的產(chǎn)量相當(dāng)(圖2)。
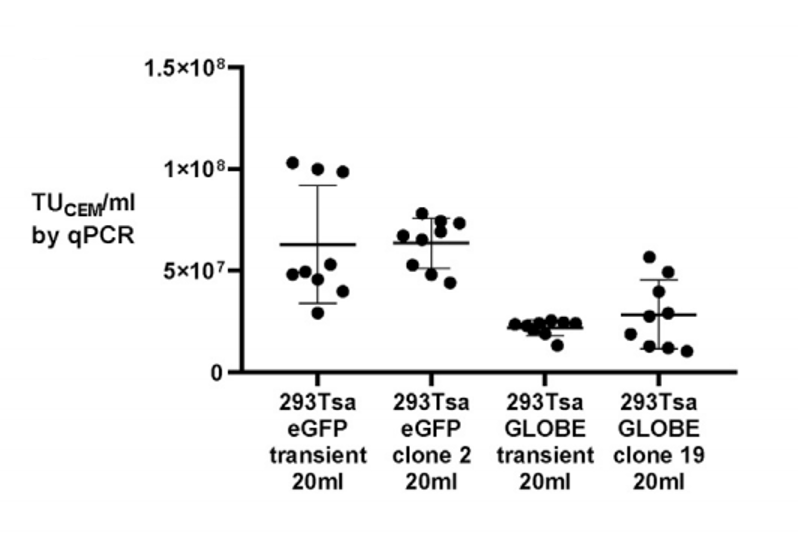
圖2:在搖瓶中通過瞬時轉(zhuǎn)染和穩(wěn)定生產(chǎn)細(xì)胞系獲得慢病毒載體滴度圖。各點表示9個搖瓶中每個的滴度
更重要的是,這些由單克隆衍生的細(xì)胞系展現(xiàn)出卓越的遺傳穩(wěn)定性——在連續(xù)傳代培養(yǎng)超過20個代次后,其載體滴度和整合的載體基因拷貝數(shù)均未發(fā)生顯著衰減(圖3)。
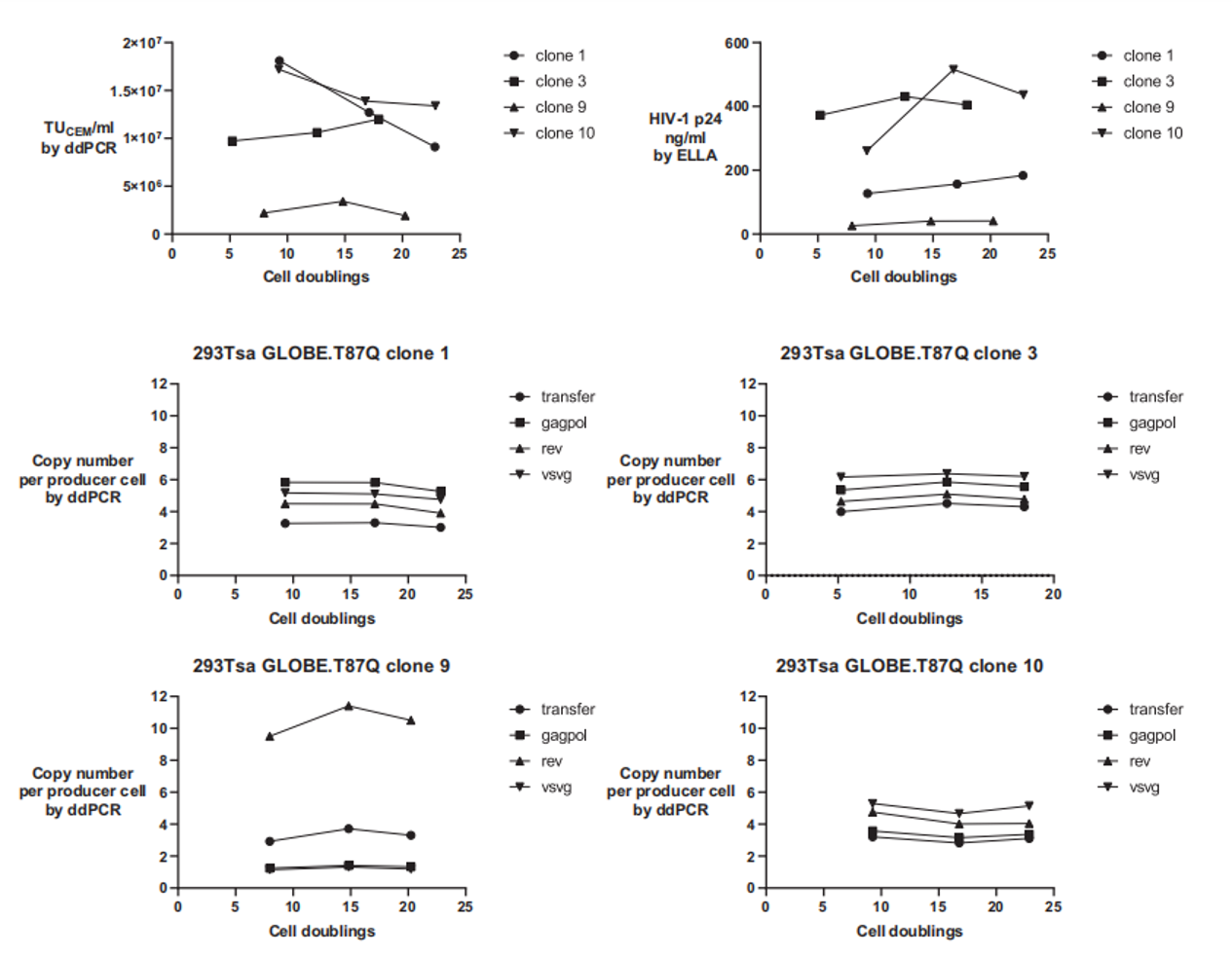
圖3:克隆在超過20個細(xì)胞倍增的過程中,功能滴度(TU/mL)和物理滴度(p24)保持穩(wěn)定。
最終,該研究成功將篩選出的克隆放大至50升一次性攪拌罐生物反應(yīng)器進(jìn)行生產(chǎn),單個批次即可收獲高達(dá)2×10¹¹總功能性TU的慢病毒載體(圖4),理論上足以滿足10名患者的治療需求。這一案例充分證明了基于單細(xì)胞打印的克隆篩選策略,是實現(xiàn)穩(wěn)定、高產(chǎn)、可規(guī)模化慢病毒生產(chǎn)工藝的基石。
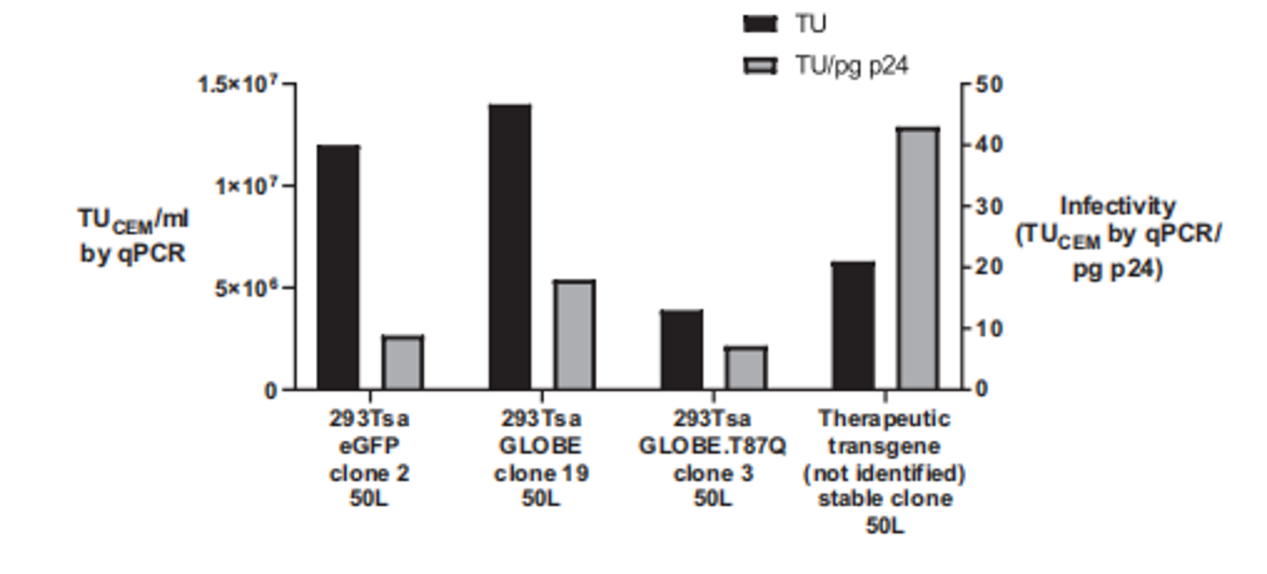
圖4:48小時后收獲50L批次的結(jié)果圖。未濃縮載體的功能滴度范圍為0.4 ~ 1.4 107 TUCEM/mL,感染性范圍為7 ~ 43 TUCEM/pg p24。
可設(shè)定細(xì)胞直徑、圓度、熒光強度等多參數(shù),真正篩選出“強壯合格”的細(xì)胞,提高單克隆形成率。
分選一個96孔板僅需1-2分鐘,單細(xì)胞率大于95%。
設(shè)備無需復(fù)雜維護(hù)清洗,采用一次性無菌打印芯片,杜絕交叉污染。
可調(diào)整液滴位置,確保液滴滴入孔板中央,細(xì)胞沉降到孔底后能輕松拍到Day0的單細(xì)胞圖片,避免ghost well問題。
分選過程自動拍攝多張噴嘴圖片,完整記錄單克隆來源,滿足監(jiān)管機構(gòu)對單克隆源性的嚴(yán)苛要求。
隨著生物制藥行業(yè)對細(xì)胞系單克隆性的要求日益嚴(yán)格,單細(xì)胞打印技術(shù)的重要性將愈發(fā)凸顯。從GSK等企業(yè)的成功實踐可以看出,單細(xì)胞打印技術(shù)是產(chǎn)業(yè)化工藝中確保克隆源性、合規(guī)性與一致性的關(guān)鍵環(huán)節(jié)。它與慢病毒生產(chǎn)技術(shù)的深度融合,正推動細(xì)胞治療工藝向更高效、規(guī)范、可追溯的方向發(fā)展。未來,我們有望見證更多基于In Vivo CAR-T的治療方案獲批上市,為全球癌癥患者帶來新的希望。而單細(xì)胞打印技術(shù),將繼續(xù)作為幕后功臣,在這一進(jìn)程中扮演不可或缺的角色。
-
2025 ASGCT | 易慕峰In Vivo體內(nèi)CAR-T技術(shù)平臺重磅亮相
-
In Vivo與Allo CAR-T:誰先攻克商業(yè)化堡壘?
-
體內(nèi)細(xì)胞療法工藝新突破:EuLV穩(wěn)轉(zhuǎn)細(xì)胞系慢病毒載體系統(tǒng)高效突破LVV生產(chǎn)瓶頸
-
Chen, Y.H., et al. (2020). Rapid Lentiviral Vector Producer Cell Line Generation Using a Single DNA Construct. Mol Ther Methods Clin Dev.
