小鼠聽覺系統與人類高度同源,而耳蝸基底膜上的毛細胞更是聽覺信號傳導的核心單元 —— 毛細胞一旦損傷便會引發不可逆聽力喪失,因此精準獲取完整、活性良好的耳蝸基底膜,是解析聽覺機制、探索耳聾病因、開發治療方案的首要前提。
但小鼠耳蝸僅綠豆大小,基底膜以毫米計,需全程顯微鏡下精細操作。靈賦拓普生物于本文整理了標準化 “七步取材法” 及實操技巧,幫你避開坑點、高效獲取高質量樣本。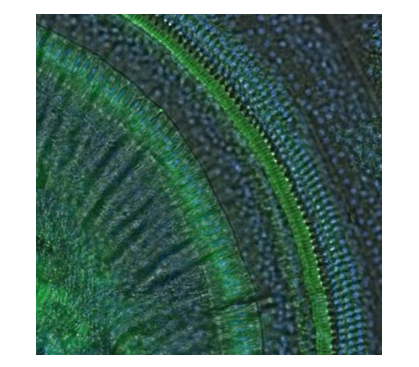

1. 解剖取顳骨:奠定樣本基礎
-
操作流程:小鼠安樂死后,將頭部用 75% 乙醇消毒;在顯微鏡下沿頭部正中從枕骨大孔處剪開顱骨,小心取出腦組織(避免牽拉損傷內耳),最后取下雙側含耳蝸、前庭及半規管的顳骨塊。
-
實操提示:剪顱骨時力度需輕柔,避免剪刀尖端觸碰內耳組織,若腦組織粘連緊密,可先用生理鹽水輕微沖洗再分離。
2. 暴露耳蝸:精準去除冗余結構
-
操作流程:取下含內耳組織的顳骨塊后,逐層去除表面的膜性組織及軟骨環樣結構,直至清晰暴露耳蝸、圓窗和前庭窗。
-
關鍵注意:軟骨環韌性較強,不可直接撕扯,需沿邊緣緩慢剝離,防止連帶損傷耳蝸外壁。
3. 打開耳蝸:把控力度是核心
-
操作流程:在顯微鏡下,用精細針頭在耳蝸頂端開一個小窗,再在底部開第二個小窗。力度需恰到好處 —— 過大易破壞內部結構,過小則無法形成后續操作通道。
-
練習建議:新手可先在廢棄顳骨上練習針頭力度,熟悉 “剛穿透骨壁、不觸及內部” 的手感后再操作正式樣本。
4. 灌注固定:維持樣本生理狀態
-
操作流程:通過開好的小窗緩慢灌注固定液,使耳蝸內結構保持其生理狀態。灌注的速度和壓力都有講究,需避免因操作不當破壞細胞形態。
-
核心原則:灌注需勻速緩慢,防止壓力驟增沖散毛細胞或基底膜,確保固定液充分覆蓋所有區域。
5. 脫鈣軟化:取出完整基底膜的關鍵
-
操作流程:將固定后的耳蝸放入脫鈣液中浸泡,軟化骨頭。這一步是后續順利剝離基底膜的關鍵 —— 脫鈣不足會導致骨頭過硬、無法分離,脫鈣過度則可能破壞細胞結構。
-
判斷標準:可通過鑷子輕捏骨壁判斷軟化程度,以 “骨壁能輕微變形但不碎裂” 為宜。
6. 剝離軟組織:暴露螺旋狀基底膜
-
操作流程:待耳蝸軟化后,輕輕剝離內部的前庭膜和其他軟組織,此時螺旋形的基底膜會逐漸暴露。
-
操作技巧:軟組織與基底膜可能存在粘連,可借助針尖輕輕挑起軟組織,避免直接拉扯導致基底膜斷裂。
7. 分離基底膜:最后一步定成敗
-
操作流程:用精細鑷子和精細解剖刀,貼近骨螺旋板輕輕分離基底膜,全程需保持動作平緩,確保基底膜完整性。
-
重點提醒:這是最關鍵的一步,若發現基底膜有撕裂風險,可暫停操作,調整鑷子角度后再繼續,切勿急躁。

成功獲取高質量基底膜,離不開以下四點核心積累: -
工具適配性:精細針頭、鑷子、解剖刀是必備工具,工具的精細度直接影響操作精度 —— 劣質工具易導致樣本劃傷或破損,需優先選擇適配微小結構操作的專用工具。
-
及時固定:組織固定不及時會導致細胞自溶,此前所有操作都會前功盡棄。建議小鼠安樂死后,30 分鐘內啟動固定流程,最大限度保留樣本活性。
-
穩定與耐心:操作時可將肘部支撐在實驗臺面上,減少手部抖動;遇到組織粘連、剝離困難時,切勿強行操作,可暫停 1-2 分鐘調整狀態,耐心是避免失誤的關鍵。
-
反復練習:沒有人第一次就能做出完美的基底膜取材。建議先用廢棄樣本練習 3-5 次,熟悉各步驟手感后再操作正式樣本,通過反復實操積累經驗,逐步提升成功率。

合格的基底膜樣本,可支撐多類關鍵實驗,為聽覺研究提供有力支撐: -
免疫熒光染色:標記特定蛋白(如毛細胞特異性蛋白),觀察其在基底膜上的表達與定位;
-
電生理記錄:通過膜片鉗等技術,研究毛細胞的機械電轉導特性,解析聽覺信號傳導機制;
-
基因表達分析:提取基底膜組織 RNA,開展 qPCR、測序等實驗,探索聽覺相關基因網絡;
-
藥物篩選:將基底膜暴露于潛在治療化合物中,檢測毛細胞存活率,評估藥物的聽力保護效果。
無論是剛接觸耳蝸取材的新手,還是需要優化流程的研究者,若在實操中遇到力度把控、脫鈣時間判斷等問題,都可交流探討。靈賦拓普生物也能提供從取材到后續實驗的技術支持,助力大家高效獲取合格樣本,少走彎路,推進聽覺領域研究更順利開展。
合作咨詢
CONTACT INFORMATION 聯系電話 0755-86325431 聯系郵箱 sales@topbiotech.com.cn 聯系地址 深圳市光明區鳳凰街道同業路恒泰裕大廈3B棟1502室 -
-
