睡眠不足(SD)或睡眠紊亂會導致持續炎癥反應,激活大腦中的星形膠質細胞和小膠質細胞,導致更高水平的促炎因子和神經損傷。
S100B主要由星形膠質細胞表達,在發展中的中樞神經系統中,作為神經營養因子和神經元存活蛋白。在成人機體中,由于神經系統損傷,S100B通常升高,這使它成為一個潛在的臨床標志物。
在動物模型中,腸道微生物通過控制免疫激活和小膠質細胞功能,參與調節宿主免疫系統和神經功能。
腸道微生物代謝產物短鏈脂肪酸(SCFAs)顯示了調節小膠質細胞的成熟和功能,被推測在微生物-腸道-大腦軸串擾中發揮中介作用。
越來越多的證據表明,腸道微生物可以影響腸道屏障的通透性,增加腸道內毒素的滲漏,激活TLR4,最終導致炎癥反應的失調。
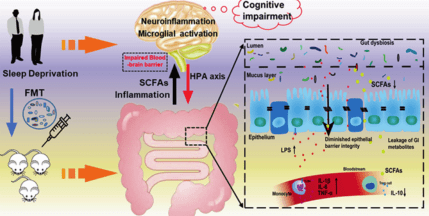 ▲ 腸道微生物群調節與睡眠剝奪相關的炎癥反應和認知障礙的示意圖
▲ 腸道微生物群調節與睡眠剝奪相關的炎癥反應和認知障礙的示意圖
睡眠不足(SD)會導致HPA軸激活增加和腸道失調。腸道微生物組的改變通過破壞腸道屏障增加有害代謝物的泄漏,導致炎癥反應。外周炎癥和短鏈脂肪酸(SCFAs)通過增加血腦屏障(BBB)的通透性進一步影響中樞免疫,導致神經炎癥和認知損害的增加。接受SD糞菌移植(FMT)的小鼠表現出類似的睡眠剝奪的有害癥狀。
北京大學第六醫院陳文浩/陸林 團隊隨機選取SD前后健康受試者的糞便樣本,并將其移植到GF小鼠體內。發現SD糞菌移植(FMT)可激活TLR4和NF-κB信號通路并損害受體小鼠的認知功能。
含有SD菌群的小鼠在海馬和內側前額葉皮層中也表現出神經炎癥和小膠質細胞活動的增加。這些發現表明, 腸道菌群失調會導致 SD 引起的外周和中樞炎癥過程以及認知缺陷,這可能為潛在的干預措施開辟道路,從而減輕睡眠不足的不利后果。
這項研究以《Gut microbiota modulates the inflammatory response and cognitive impairment induced by sleep deprivation》為題發表于國際期刊《Molecular Psychiatry》(IF=15.99)

急性睡眠缺失會導致外人群促炎細胞因子水平急劇升高,包括TNF-α、IL-1β、IL-6,并且抗炎細胞因子IL-10水平較低。
SD后,糞便微生物組α-多樣性顯著降低,腸屏障通透性標志物血清連蛋白水平顯著升高,血腦屏障通透性標志物血清S100β水平顯著升高。
這些結果表明SD導致認知障礙和外周炎癥通路激活的增加。和人的結果相似,SPF小鼠睡眠缺失會導致皮質酮、TNF-α、IL-1β、IL-6水平顯著升高,并且抗炎細胞因子IL-10水平顯著降低。
相比之下,在GF小鼠中,這些炎癥細胞因子的水平沒有差異,這表明GF小鼠在SD誘導下的炎癥反應較SPF小鼠弱。SPF和GF小鼠的血清S100β水平顯著增高。
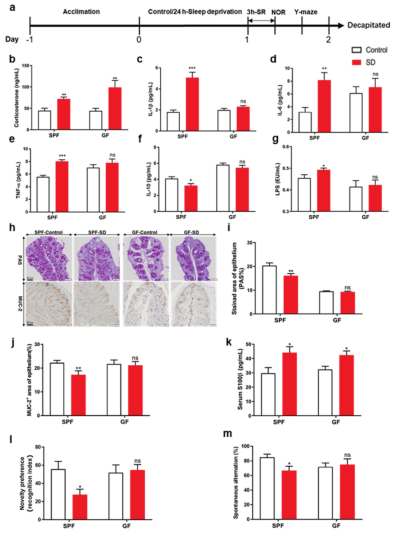 ▲ 腸道微生物群的缺失抑制了睡眠剝奪(SD)誘導的小鼠炎癥反應和認知障礙
▲ 腸道微生物群的缺失抑制了睡眠剝奪(SD)誘導的小鼠炎癥反應和認知障礙
a. 小鼠睡眠剝奪和行為測試的示意圖。
b. 在無特定病原體 (SPF) 和無菌 (GF) 小鼠中,SD后血清皮質酮水平增加。
c.-f. 睡眠剝奪顯著增加血清 IL-1β、IL-6 和 TNF-α 水平,并顯著降低 SPF 小鼠的 IL-10 水平,GF 小鼠沒有差異。
g. 睡眠剝奪顯著增加了 SPF 小鼠的血清 LPS 水平,而在GF小鼠中沒有差異。
h. 小鼠結腸中PAS和Muc-2 的免疫組織化學染色。比例尺=50μm。
i.-j. 免疫組化染色定量顯示,SPF小鼠杯狀細胞陽性細胞面積和結腸Muc-2在SD后顯著減少,GF小鼠無差異。
k. SD后 SPF 和 GF 小鼠血清中血腦屏障通透性標志物S100β均增加。
l.-m. 行為測試表明,在SPF小鼠SD24小時后,NOR測試中的新奇偏好(由識別指數(RI)表示)和 Y 迷宮測試中的自發交替顯著降低。
數據表示為平均SEM (n=10 12)。*p<0.05,**p<0.01,***p<0.001。SR 睡眠恢復,ns 無統計學意義。
研究還觀察到SD后用人類微生物菌群處理的小鼠Iba1陽性細胞的數量和面積增加,表明小膠質細胞激活增加。SD后,在接受人類菌群的小鼠血清中,血腦屏障通透性標志物S100β顯著增加。
這些結果說明,腸道微生物群的改變可能是引發神經炎癥的主要事件。而神經炎癥與SD誘導的認知障礙消退有關。在NOR試驗中,與rBL小鼠相比,SD相關菌群處理的小鼠RI降低。在Y迷宮試驗中,rSD小鼠與rBL小鼠相比,交替率也降低了12.97%。
此外,FMT小鼠的認知表現與腦內循環丁酸水平和神經炎癥水平顯著相關。
綜上所述,人類SD菌群的傳遞導致FMT小鼠神經炎癥和認知損傷的增加。
文獻中使用Elabscience?產品
|
產品貨號 |
應用 |
檢測靶標 |
種屬 |
測定樣本 |
|
ELISA |
Mouse S100β |
Mouse |
Serum; Cell lysate |
