內(nèi)部審核主要是由實(shí)驗(yàn)室自己或以實(shí)驗(yàn)室的名義對(duì)實(shí)驗(yàn)室自身質(zhì)量管理體系的符合性、有效性、適合性進(jìn)行審核。審核的依據(jù)一般應(yīng)包括質(zhì)量管理體系文件及相關(guān)質(zhì)量管理規(guī)定。實(shí)驗(yàn)室也可根據(jù)審核的目的不同來決定審核的依據(jù)。實(shí)驗(yàn)室通過內(nèi)部審核是自我診斷、自我完善機(jī)制的關(guān)鍵要素,是實(shí)驗(yàn)室確保實(shí)驗(yàn)室活動(dòng)準(zhǔn)確、可靠、有效的重要保證。
新版認(rèn)可準(zhǔn)則取消了內(nèi)部審核周期的建議,內(nèi)部審核的周期和覆蓋范圍應(yīng)當(dāng)基于風(fēng)險(xiǎn)分析。但對(duì)于初次申請(qǐng)認(rèn)可的實(shí)驗(yàn)室,CNAS要求實(shí)驗(yàn)室體系運(yùn)行6個(gè)月以上,進(jìn)行過完整的內(nèi)部審核和管理評(píng)審,并能達(dá)到預(yù)期目的,且所有體系要素應(yīng)有運(yùn)行記錄內(nèi)部審核應(yīng)覆蓋CNAS-CL01在相關(guān)領(lǐng)域的應(yīng)用說明。對(duì)于如何進(jìn)行有效的內(nèi)部審核CNAS-GL011《實(shí)驗(yàn)室和檢驗(yàn)機(jī)構(gòu)內(nèi)部審核指南》為實(shí)驗(yàn)室如何實(shí)施內(nèi)部審核提供了指導(dǎo)。
內(nèi)部審核有效性的評(píng)價(jià)問題
新版準(zhǔn)則對(duì)內(nèi)部審核要求的調(diào)整,在現(xiàn)場(chǎng)評(píng)審中,評(píng)審專家關(guān)注的要點(diǎn):
1、內(nèi)部審核是否為有計(jì)劃的活動(dòng);
2、內(nèi)部審核方案是否考慮了實(shí)驗(yàn)室活動(dòng)的重要性、影響實(shí)驗(yàn)室的變化和以前的審核結(jié)果;
3、審校方案是否包括了審核頻次、方法、職責(zé)、策劃要求和報(bào)告;
4、是否規(guī)定了每次審核的準(zhǔn)則和范圍;
5、審核過程是否與實(shí)驗(yàn)室管理體系或方案要求相匹配;
6、對(duì)內(nèi)部審核發(fā)現(xiàn)開出的“不符合”是否針對(duì)事實(shí)進(jìn)行了原因分析;
7、采取的糾正措施是否適宜;
8、糾正措施是否有效實(shí)施并驗(yàn)證閉環(huán);
9、審核結(jié)束后,是否及時(shí)總結(jié)審核結(jié)果,最終向相關(guān)管理層報(bào)告并保存內(nèi)部審核記錄。
當(dāng)評(píng)審時(shí)發(fā)現(xiàn)本應(yīng)由內(nèi)部審核發(fā)現(xiàn)的問題而未能發(fā)現(xiàn),例如管理體系的運(yùn)行與實(shí)驗(yàn)室管理體系文件的規(guī)定不符,特別是實(shí)驗(yàn)室的規(guī)定超出認(rèn)可準(zhǔn)則要求,當(dāng)這種情況在一個(gè)評(píng)審中多次發(fā)生時(shí),評(píng)審組會(huì)進(jìn)一步評(píng)審實(shí)驗(yàn)室內(nèi)部審核員的審核能力。
內(nèi)部審核活動(dòng)的充分性問題
內(nèi)部審核是實(shí)驗(yàn)室對(duì)管理體系進(jìn)行自我審核,以驗(yàn)證其運(yùn)作是否持續(xù)符合管理體系和相關(guān)標(biāo)準(zhǔn)的要求,因此實(shí)驗(yàn)室管理體系所涉及的要素和部門都應(yīng)納入內(nèi)部審核范圍。由于實(shí)驗(yàn)室檢測(cè)/校準(zhǔn)能力和組織結(jié)構(gòu)的差異,不同實(shí)驗(yàn)室管理體系所涉及的部門不同,審核覆蓋的部門也有所不同。有時(shí),實(shí)驗(yàn)室以外的某些部門也可能需要納人內(nèi)部審核。
認(rèn)可準(zhǔn)則中 8.8.1 指出“實(shí)驗(yàn)室應(yīng)按照策劃的時(shí)間間隔進(jìn)行內(nèi)部審核,以提供有關(guān)管理體系是否符合實(shí)驗(yàn)室自身管理體系要求(包括實(shí)驗(yàn)室活動(dòng))以及符合準(zhǔn)則要求的信息”。而在實(shí)際認(rèn)可實(shí)踐中,實(shí)驗(yàn)室內(nèi)部審核核查表往往是針對(duì)認(rèn)可準(zhǔn)則條款的核查,而忽略了是否滿足實(shí)驗(yàn)室自身要求,也失去了對(duì)實(shí)驗(yàn)室管理體系文件適用性審查的合適時(shí)機(jī)。
審核準(zhǔn)則是內(nèi)審員可以依據(jù)的一組方針、政策、合同、程序及要求等。內(nèi)審員在審核中將審核證據(jù)與審核的準(zhǔn)則進(jìn)行比較以此來確定不符合。審核準(zhǔn)則首先是認(rèn)可準(zhǔn)則,其次是行業(yè)標(biāo)準(zhǔn)、法律法規(guī)、管理體系文件等(適用時(shí))。
審核的范圍為具體的實(shí)驗(yàn)室活動(dòng)、場(chǎng)所、部門及設(shè)施,包括實(shí)驗(yàn)室外受實(shí)驗(yàn)室管理控制的項(xiàng)目、場(chǎng)所、部門及設(shè)施設(shè)備,如 POCT。
 參考文獻(xiàn):CNAS-GL011-2018實(shí)驗(yàn)室和檢驗(yàn)機(jī)構(gòu)內(nèi)部審核指南.pdf
參考文獻(xiàn):CNAS-GL011-2018實(shí)驗(yàn)室和檢驗(yàn)機(jī)構(gòu)內(nèi)部審核指南.pdf
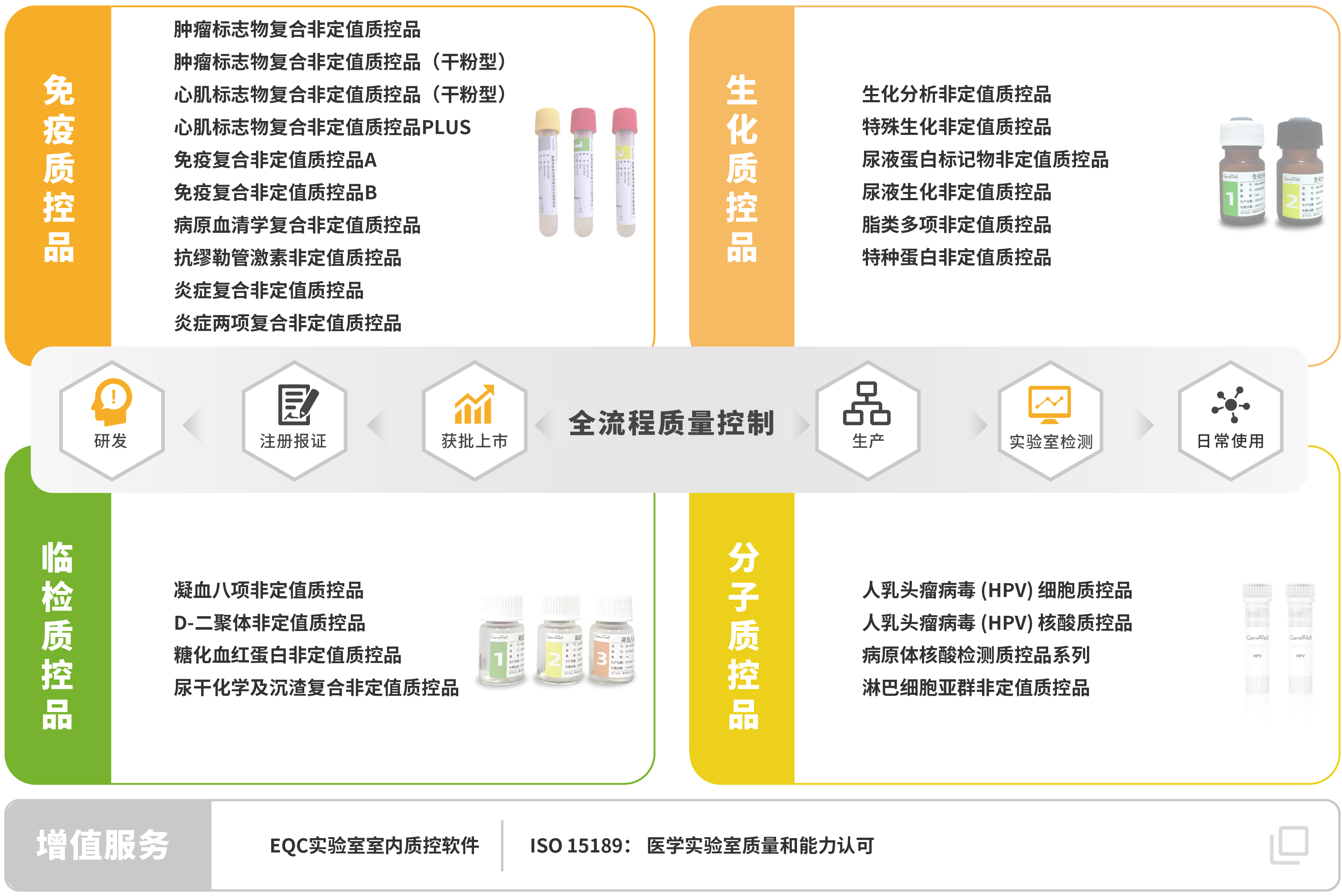
菁良臨床質(zhì)控一站式解決方案
菁良通過自主研發(fā)和國產(chǎn)化生產(chǎn),向體外檢測(cè)行業(yè)用戶及合作伙伴提供全球領(lǐng)先的臨床實(shí)驗(yàn)室質(zhì)量控制解決方案,協(xié)助醫(yī)學(xué)實(shí)驗(yàn)室實(shí)現(xiàn)全面質(zhì)量管理。現(xiàn)已推出專業(yè)的質(zhì)控管理軟件,第三方質(zhì)控品涵蓋免疫診斷、生化診斷、分子診斷等體外診斷細(xì)分領(lǐng)域。
關(guān)于菁良
菁良科技(深圳)有限公司是全球領(lǐng)先的提供體外診斷標(biāo)準(zhǔn)品與質(zhì)控品的研發(fā)創(chuàng)新型高科技企業(yè)。
菁良通過自主研發(fā)的平臺(tái),向體外檢測(cè)行業(yè)用戶及合作伙伴提供全球領(lǐng)先的標(biāo)準(zhǔn)物質(zhì)、第三方質(zhì)控產(chǎn)品和企業(yè)參考品服務(wù),助力提高行業(yè)檢測(cè)準(zhǔn)確率。參與多項(xiàng)由檢測(cè)領(lǐng)域行業(yè)龍頭和監(jiān)管機(jī)構(gòu)發(fā)起的標(biāo)準(zhǔn)制定工作,多次支持由臨檢中心發(fā)起的室間質(zhì)量評(píng)價(jià) (EQA)/能力驗(yàn)證項(xiàng)目。
菁良秉承著“精準(zhǔn)制標(biāo),匠心良造”的理念,懷抱著“提高體外檢測(cè)準(zhǔn)確率,助力精準(zhǔn)醫(yī)學(xué)快速發(fā)展”的愿景,致力于建立規(guī)范化的中國體外檢測(cè)金標(biāo)準(zhǔn)平臺(tái)。
