各位實驗室同仁、相關(guān)機構(gòu)注意啦!
中國合格評定國家認(rèn)可委員會(CNAS)對《實驗室認(rèn)可規(guī)則》(CNAS-RL01)進行了重要修訂,新版CNAS-RL01:2025將于2025年6月30日正式發(fā)布,并即日起實施!
本次修訂聚焦適用性與可操作性提升,雖未涉及重大結(jié)構(gòu)性調(diào)整,但對多項關(guān)鍵內(nèi)容進行了優(yōu)化與補充,實驗室在申請、運行及管理過程中需重點關(guān)注!

一、新版文件獲取方式
登錄CNAS官網(wǎng)(https://www.cnas.org.cn)→ 進入【認(rèn)可規(guī)范】欄目 → 選擇【實驗室—認(rèn)可規(guī)則—專用規(guī)則】即可查找下載。
二、主要修訂內(nèi)容速覽(附重點解讀)
|
序號 |
修訂要點 |
關(guān)鍵變化 |
影響提示 |
|
1 |
術(shù)語定義更新 |
如“授權(quán)簽字人”新增“直接能力簽發(fā)帶認(rèn)可標(biāo)識/聲明認(rèn)可狀態(tài)報告”的要求;“能力驗證”“實驗室間比對”等術(shù)語同步國際標(biāo)準(zhǔn)(ISO/IEC 17043:2023),刪除冗余注釋,強調(diào)“表現(xiàn)”與“鑒定”環(huán)節(jié)。 |
申請授權(quán)簽字人及參與能力驗證/比對的實驗室需注意新定義下的責(zé)任與流程。 |
|
2 |
申請條件細(xì)化 |
明確申請人需“自愿申請”,CNAS依據(jù)認(rèn)可準(zhǔn)則對申請范圍評審并決策,語言更簡潔規(guī)范。 |
申請流程不變,但需確保申請范圍與實際能力嚴(yán)格匹配。 |
|
3 |
評審安排靈活性 |
受理申請后3個月內(nèi)安排評審,新增“不可抗力因素”作為可延期理由。 |
若遇不可抗力導(dǎo)致延誤,實驗室可合理說明。 |
|
4 |
評審員公正性要求升級 |
申請人不得拒絕指定評審員的理由,新增“保密性”要求(原僅“公正性”)。 |
實驗室需配合評審工作,不得僅以主觀理由拒絕評審員。 |
|
5 |
專項監(jiān)督機制完善 |
新增“專項監(jiān)督”定義(針對獲準(zhǔn)認(rèn)可機構(gòu)合規(guī)性的不定期檢查),并允許CNAS邀請無利益沖突的行業(yè)權(quán)威技術(shù)機構(gòu)協(xié)助(僅承擔(dān)事務(wù)性工作)。 |
實驗室需重視日常合規(guī)管理,避免因合規(guī)問題觸發(fā)專項監(jiān)督。 |
|
6 |
管理體系運行要求 |
正式運行時間仍為6個月以上,但明確需覆蓋“全部場所和能力范圍”(原為“申請范圍”),文件需具備可操作性。 |
多場所實驗室需確保各場所體系均有效運行并符合要求。 |
|
7 |
不予受理再申請限制 |
因誠信等問題被拒后,36個月內(nèi)不得再次申請,CNAS保留進一步限制權(quán)利(原表述為“不再受理”)。 |
誠信問題后果更明確,實驗室需珍惜信用記錄。 |
|
8 |
測量結(jié)果溯源性補充 |
無法溯源至SI單位時,需通過參考物質(zhì)(RM)標(biāo)準(zhǔn)值、公認(rèn)方法或?qū)嶒炇议g比對證明一致性,優(yōu)先選擇CNAS/APAC/ILAC認(rèn)可實驗室比對。 |
檢測結(jié)果溯源性要求更具體,比對實驗室資質(zhì)有明確指向。 |
|
9 |
人員兼職限制 |
從事檢測/校準(zhǔn)/鑒定人員不得“同時在其他實驗室兼職”(原為“不得在其他同類型實驗室從事同類活動”)。 |
人員管理更嚴(yán)格,避免利益沖突。 |
|
10 |
現(xiàn)場評審中止情形擴展 |
中止評審的情形從7項增至9項(如合并原7.8/7.9條款),新增“多個項目/參數(shù)不具備能力”“提供不真實記錄”“管理體系失效”等。 |
實驗室需全面準(zhǔn)備評審材料,確保能力覆蓋與記錄真實性。 |
|
11 |
變更通知范圍擴大 |
獲準(zhǔn)認(rèn)可實驗室除原“名稱/地址/標(biāo)準(zhǔn)/授權(quán)簽字人”外,新增“最高管理者、法定代表人”變更需提交《變更申請書》,其他信息(如質(zhì)量/技術(shù)負(fù)責(zé)人)需及時更新。 |
高層管理人員變動也需正式申報! |
|
12 |
處置程序期間限制新增 |
啟動能力/資格處置程序后,暫停受理“名稱變更、暫停/注銷資格、縮小能力范圍”等申請(原僅限縮小范圍等)。 |
處置期間實驗室需謹(jǐn)慎處理其他變更需求。 |
|
13 |
新增義務(wù)條款 |
實驗室需接受專項監(jiān)督(新增義務(wù)),并在受行政/刑事處罰后20個工作日內(nèi)書面告知CNAS。 |
合規(guī)管理需常態(tài)化,處罰信息及時報備。 |
三、重點提醒
過渡安排:新版規(guī)則自發(fā)布日(2025年6月30日)起立即實施,無緩沖期,請各實驗室盡快對照修訂內(nèi)容自查。
核心變化:聚焦術(shù)語規(guī)范性、評審嚴(yán)謹(jǐn)性、合規(guī)管理強化及人員/場所管理細(xì)化,實驗室需重點關(guān)注授權(quán)簽字人職責(zé)、測量溯源性要求、現(xiàn)場評審中止情形及變更申報范圍。
文件下載:登錄CNAS官網(wǎng)“認(rèn)可規(guī)范-實驗室-認(rèn)可規(guī)則-專用規(guī)則”欄目,一鍵獲取最新版CNAS-RL01:2025。
結(jié)語:規(guī)則更新是為了更好地服務(wù)實驗室高質(zhì)量發(fā)展!建議各機構(gòu)組織相關(guān)人員學(xué)習(xí)新版規(guī)則,確保申請與運行全流程符合最新要求。如有疑問,可隨時聯(lián)系CNAS秘書處或關(guān)注官方后續(xù)解讀。
立即行動:點擊CNAS官網(wǎng)(https://www.cnas.org.cn)鏈接下載新版文件,對照檢查,從容應(yīng)對!
菁良臨床質(zhì)控一站式解決方案
菁良通過自主研發(fā)和國產(chǎn)化生產(chǎn),向體外檢測行業(yè)用戶及合作伙伴提供全球領(lǐng)先的臨床實驗室質(zhì)量控制解決方案,協(xié)助醫(yī)學(xué)實驗室實現(xiàn)全面質(zhì)量管理。現(xiàn)已推出專業(yè)的質(zhì)控管理軟件及ISO15189質(zhì)量管理體系咨詢服務(wù),第三方質(zhì)控品涵蓋免疫診斷、生化診斷、分子診斷等體外診斷細(xì)分領(lǐng)域。
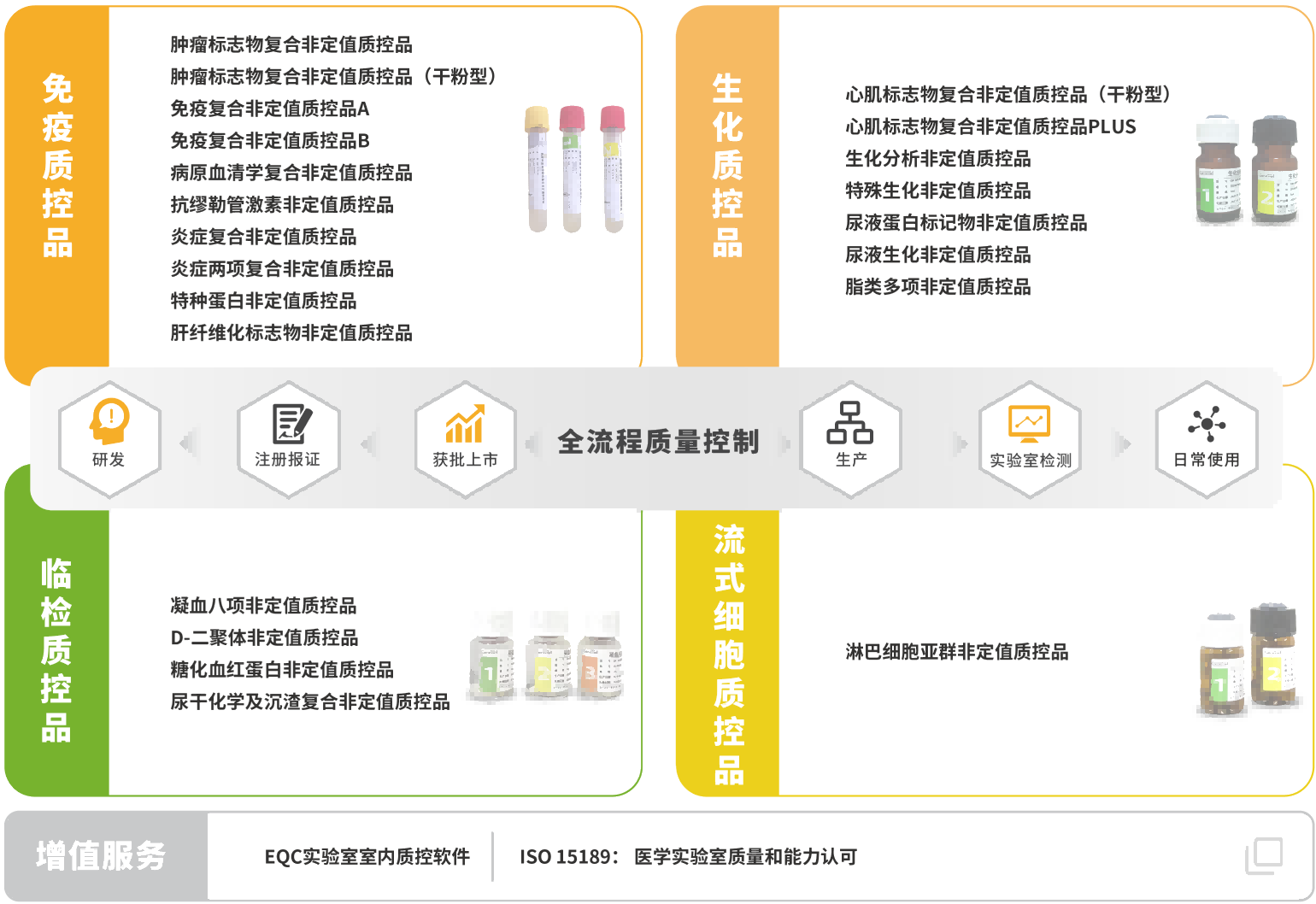
關(guān)于菁良
菁良科技(深圳)有限公司是全球領(lǐng)先的提供體外診斷標(biāo)準(zhǔn)品與質(zhì)控品的研發(fā)創(chuàng)新型高科技企業(yè)。
菁良通過自主研發(fā)的平臺,向體外檢測行業(yè)用戶及合作伙伴提供全球領(lǐng)先的標(biāo)準(zhǔn)物質(zhì)、第三方質(zhì)控產(chǎn)品和企業(yè)參考品服務(wù),助力提高行業(yè)檢測準(zhǔn)確率。參與多項由檢測領(lǐng)域行業(yè)龍頭和監(jiān)管機構(gòu)發(fā)起的標(biāo)準(zhǔn)制定工作,多次支持由臨檢中心發(fā)起的室間質(zhì)量評價 (EQA)/能力驗證項目。
菁良秉承著“精準(zhǔn)制標(biāo),匠心良造”的理念,懷抱著“提高體外檢測準(zhǔn)確率,助力精準(zhǔn)醫(yī)學(xué)快速發(fā)展”的愿景,致力于建立規(guī)范化的中國體外檢測金標(biāo)準(zhǔn)平臺。
