一、背景及應用介紹
支原體是一類沒有細胞壁、形態多變、尺寸極小的簡單原核生物。它們既是重要的人類和動物病原體,也是細胞培養中棘手且危害巨大的污染物。有報道顯示Giemsa染色血細胞感染支原體,SEM透射電鏡,以及激光共聚焦Confocol染色觀察細胞感染支原體[1,2,3]。見圖1,2。

圖1

圖2
支原體對細胞治療產品的具體危害:
1. 對細胞本身的影響
(1)改變細胞生物學功能:與細胞競爭營養,分泌代謝廢物,抑制細胞增殖和代謝,甚至導致細胞死亡。
(2)干擾細胞基因表達:改變宿主細胞的DNA、RNA和蛋白質合成,可能導致治療性細胞(如CAR-T細胞、干細胞)關鍵功能喪失(如殺傷腫瘤能力、分化潛能)。
(3)引起遺傳不穩定性:可能導致宿主細胞染色體畸變,帶來不可預見的風險。
2. 對患者的風險
(1)引發全身性感染:細胞產品被直接回輸至患者體內,大量支原體可導致敗血癥或菌血癥,對免疫系統脆弱的患者是致命威脅。
(2)加劇細胞因子釋放綜合征(CRS):支原體成分可能觸發或加劇CRS,導致難以控制的炎癥風暴。引起過敏反應等其他免疫副作用。
(3)導致治療失敗:受污染的細胞產品可能完全失效,患者不僅無法獲益,更可能錯過最佳治療時機。
3. 對生產過程的挑戰
(1)交叉污染:支原體極易在培養箱、操作臺、培養基等之間傳播,污染整個生產線。
(2)檢測耗時:法規要求的培養法檢測需28天,與細胞產品“現做現用”的緊迫時間窗口存在巨大矛盾。
監管與質量控制要求
鑒于其極端危害,全球監管機構(如FDA、EMA、NMPA)對支原體檢測有強制性和放行必檢的要求。傳統方法有培養法和指示細胞培養法,但是NAT法靈敏度,檢測效率更高,是發展趨勢[1-9]。
檢測標準:
(1)培養法:黃金標準,但耗時長達28天。
(2)指示細胞培養法(DNA熒光染色法):常用替代方法,更快(約1周),靈敏度高,但操作繁瑣。
(3)核酸擴增技術(NAT):最快(1天內),靈敏度極高,已成為各國藥典認可的重要方法(如qPCR法)。
在細胞治療產品的研發與生產過程中,病原體污染可能導致嚴重的臨床風險,而傳統檢測方法(如培養法)存在周期長、靈敏度不足等局限性。熒光定量PCR憑借其高靈敏度、快速和特異性強的優勢,成為細胞治療質量控制的關鍵技術。本試劑盒針對細胞治療產品的特色需求開發,可精準檢測多種病原體污染物,確保從細胞庫建立到終產品放行的全流程安全性,為細胞治療產品的合規化生產提供可靠保障。

二、產品目錄

三、實驗原理
TaqMan探針法是一種基于熒光定量PCR的檢測技術,通過特異性引物和熒光標記的探針與目標核酸結合,探針5’端標記有熒光報告基團(Reporter, R),3’端標記有熒光淬滅基團(Quencher, Q)。探針完整時,R發射的熒光能量被Q基團吸收,無熒光。在qPCR擴增過程中,Taq酶切割探針,使熒光報告基團與淬滅基團分離,產生熒光信號,其強度與目標核酸數量成正比,從而實現高特異性、高靈敏度的定量分析。

四、試劑盒優勢
超敏檢測:靈敏度達1-10拷貝/μL,可識別極微量污染風險。
精準鑒別:探針特異性識別靶序列,避免假陽性/假陰性。
全程監控:覆蓋從細胞建庫、培養監控到終產品放行全流程。
應用廣泛:適用細胞治療、生物制藥、科研等多個場景。
平臺兼容:兼顧不同廠家及型號qPCR儀。
合規可靠:嚴格符合ChP/EP/USP等藥典標準。
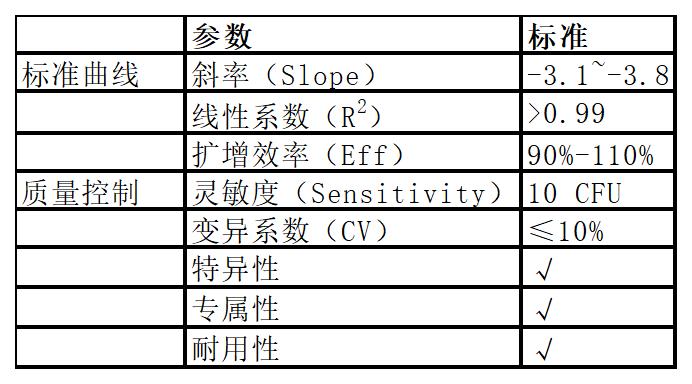
五、性能指標
符合《歐洲藥典》(EP 2.6.7)、《美國藥典》(USP 63)、《日本藥典》(JP 18)中對支原體的檢測要求。
1.靈敏度與檢測限
使用本產品靈敏度可達至少10 CFU/mL,檢出比例均達95%以上。
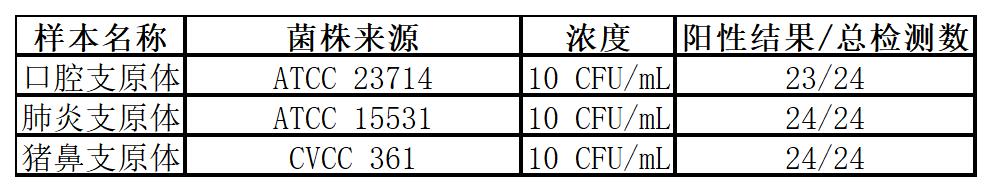
2.專屬性與特異性
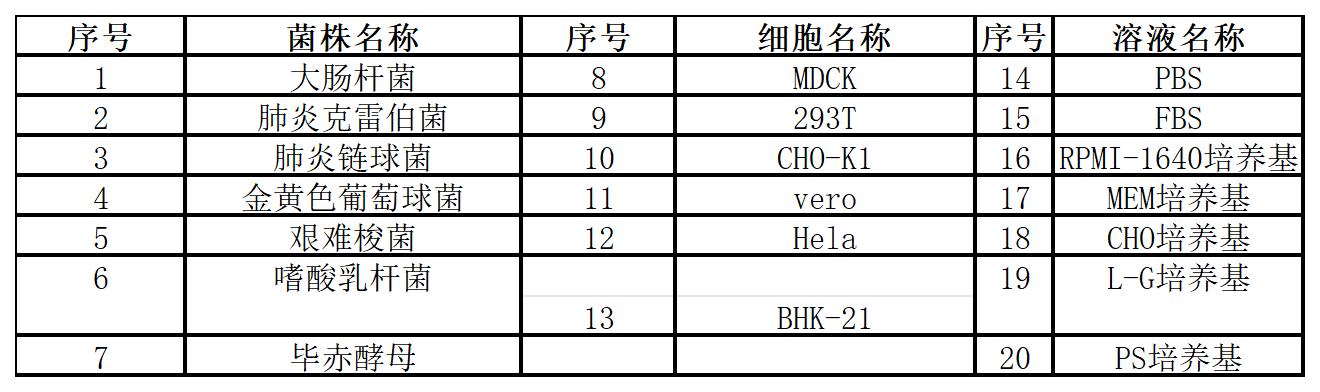
可特異性檢測100多種支原體,與以下細菌、真菌、細胞基因組、培養基等無交叉反應,無CT值。
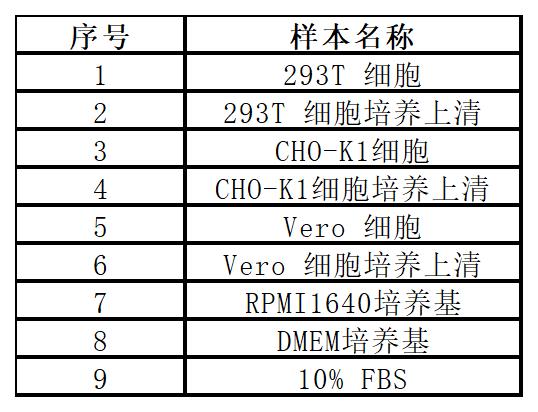
3.基質效應
在以下基質中加入支原體標準品,試劑盒檢測結果與性能不受影響。
4.凍融穩定性
試劑盒經反復凍融1-5次,檢測結果和性能不受影響。
5.重復性
試劑盒批內與批次間變異系數(CV)均小于10%,重復性好。
6.兼容性
使用不同品牌熒光定量PCR儀:ABI 7500、博日FQD-96A和BIO-RAD CFX96,檢測相同樣本,均可準確鑒定支原體陽性/陰性,ABI 7500靈敏度優于后兩者。
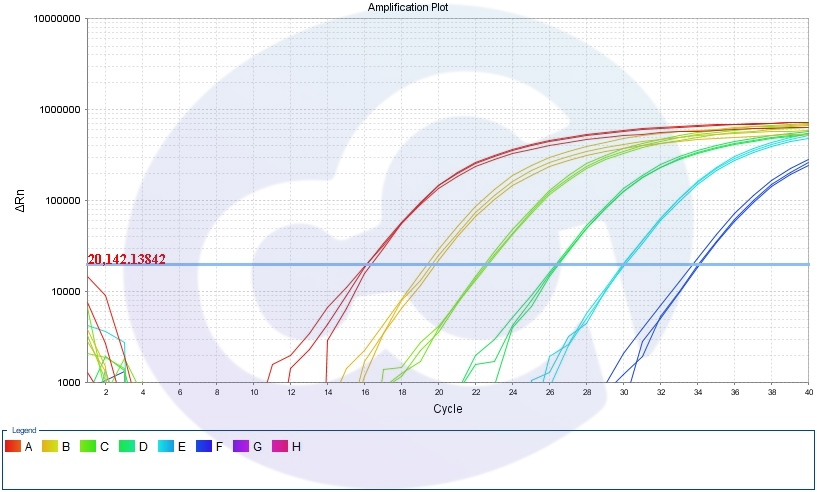
六、檢測結果(以支原體為例)
- 擴增曲線
2. 標準曲線
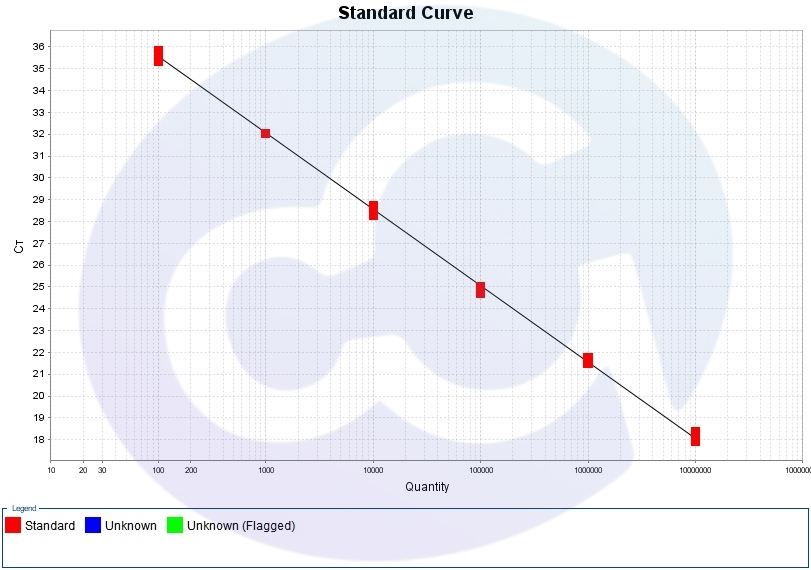

本系列產品基于Taqman探針法,實現目標病原體核酸的定性和定量檢測。適用于細胞治療、生物制藥、科研等領域,覆蓋從細胞建庫、培養監控到終產品放行的全流程,精準檢測微生物(細菌、真菌、支原體、病毒)污染,符合藥典標準及法規要求,為細胞治療產品的安全性提供可靠保障。
Reference:
[1]Images by Martina Maritan.
[2]H S Çetin et al. Response to doxycycline and oxytetracycline treatments in cats infected with Mycoplasma spp. and analysis of haemato-clinical findings and risk factors. Trop Biomed. 2021. 38(2):149-158.
[3]B. B. A. Raymond, et al. Mycoplasma hyopneumoniae resides intracellularly within porcine epithelial cells. Scientific Reports. 2018. 8:17697.
[4] 《中國藥典》,<3301>.
[5] USP <63> Mycoplasma Tests.
[6] European Pharmacopoeia 11th Edition,<2.6.7. Mycoplasmas>. Appendix: Nucleic acid amplification techniques.
[7] EMA Guideline on the quality, non-clinical and clinical aspects of medicinal products containing genetically modified cells.
[8] ICH Q5A(R1): Viral Safety Evaluation of Biotechnology Products Derived from Cell Lines of Human or Animal Origin.
[9]ICH Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products.
