酵母是生物大分子藥物最常用的表達(dá)系統(tǒng)之一。如釀酒酵母、畢赤酵母和漢遜酵母。根據(jù)FDA、ICH、CDE等機(jī)構(gòu)規(guī)定,和《中國(guó)藥典》,USP法規(guī)要求,滿足和藥企需求,填補(bǔ)市場(chǎng)空白,賽唐生物開發(fā)三種酵母專屬HCP ELISA檢測(cè)試劑盒。
背景:
酵母表達(dá)系統(tǒng)是一種最常見的真菌表達(dá)系統(tǒng)。通常用于傳統(tǒng)疫苗,如疫苗(如乙肝、HPV)、胰島素類、抗體片段(如VHH);糖蛋白(如EPO)等,相對(duì)原核和哺乳動(dòng)物表達(dá)細(xì)胞有特殊的優(yōu)勢(shì)。如,可進(jìn)行翻譯后修飾,如糖基化,易基因修飾,低免疫原性,低生產(chǎn)成本等,見表1.1。
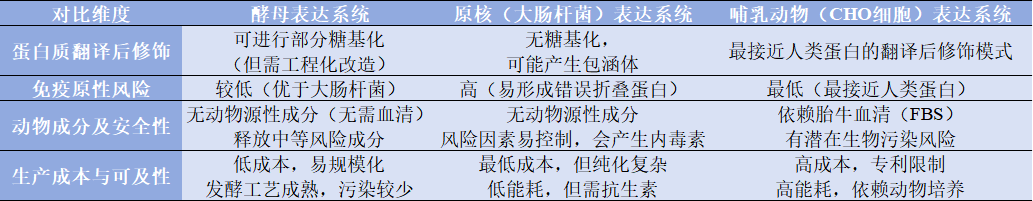
表1.1
酵母對(duì)蛋白的糖基化修飾效果較好,又可以分為甲基營(yíng)養(yǎng)型酵母和非甲基營(yíng)養(yǎng)型酵母[2]。其中,非甲基營(yíng)養(yǎng)型酵母,包括釀酒酵母(S288c、A634A、BY4716、CEN.PK、∑1278b、SK1、BJ5464、BY4742 和 W303等)、解脂耶氏酵母(W29、E150、E129、YB423 和 CX161-1B等)。甲基營(yíng)養(yǎng)型酵母,包括畢赤酵母(Y-11430/X-33 野生型、Mut+ (AOX1+, AOX2+)/Muts (AOX1−, AOX2+)/Mut− (AOX1−, AOX2)甲醇利用不同型、SMD1163 strain (his4pep4prb1)/SMD1165 strain (his4prb1)/SMD1168 strain (his4pep4)蛋白酶活性缺失型、GS115 (his4)/KM71 (Δaox1::SARG4 his4 arg4)/SMD1168 (His4, pep4)組氨酸脫氫酶缺失型)、漢遜酵母(CBS4732 strain (CCY38-22-2,ATCC34438,NRRL-Y-5445) /DL-1 strain (NRRL-Y-7560; ATCC26012)/NCYC495 strain(CBS1976;ATAA14754, NRLLY-1798))[1-3]。
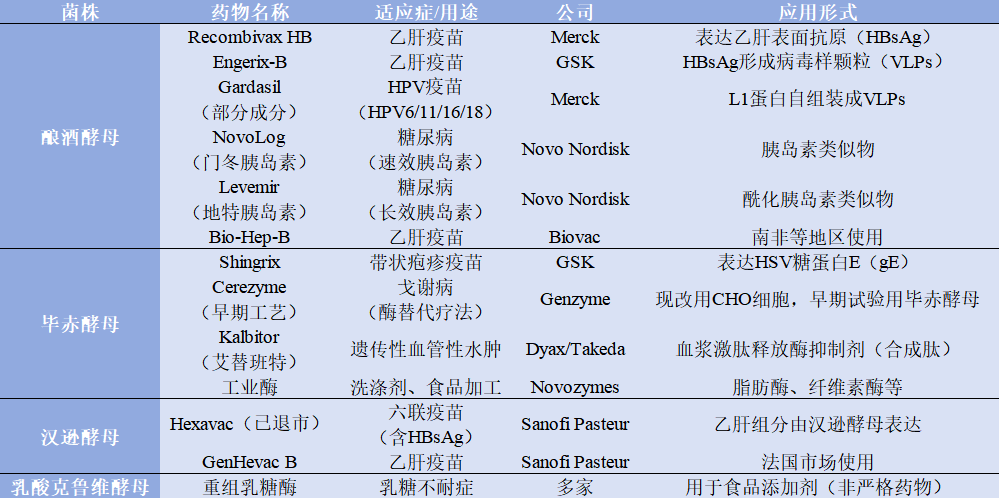
表1.2

表1.3
1.1畢赤酵母表達(dá)系統(tǒng):
甲基營(yíng)養(yǎng)型酵母是一種優(yōu)秀的用于生物醫(yī)藥和工業(yè)酶生產(chǎn)的蛋白表達(dá)系統(tǒng)。有著細(xì)胞高密度培養(yǎng)、容易使用、快速表達(dá)、低成本和翻譯后修飾等優(yōu)點(diǎn)。
以畢赤酵母為例,該宿主有著甲醇調(diào)節(jié)的乙醇氧化酶啟動(dòng)子(PAOX1),高效的分泌構(gòu)造,轉(zhuǎn)錄后修飾和特定培養(yǎng)基中的高密度生長(zhǎng)能力[4]。AOX1和AOX2基因編碼的乙醇氧化酶,是甲醇氧化通路中的一個(gè)酶。根據(jù)其突變類型,可以繼續(xù)分出多種類型菌株系。由于該品系酵母含有AOXI啟動(dòng)子,來代謝甲醇,作為誘導(dǎo)蛋白表達(dá)的誘導(dǎo)物。在大批量生產(chǎn)優(yōu)化后,可以達(dá)到20g/L的酶產(chǎn)量。
常用的商業(yè)化的畢赤酵母品系有GS115, X-33,Pichia PinkTM和KM71。還有蛋白酶缺陷品系,如SMD1168(his4,pep4,::URA3,ura3)和SMD1168H (pep4);野生型,如BG10,X-33;糖基化品系,如SuperMan5(HIS4+,Och1-disruption), SuperMan5(HIS4+, pep4, Och1 disruption);營(yíng)養(yǎng)缺陷型品系,如PichiaPink™(ade2), GS115(his4)。配套使用的表達(dá)載體有 pJAN-s1(BioGrammatics), pPICZ(Thermo Fisher Scientific), pD902/pD905(DNA2.0)。生產(chǎn)的工業(yè)酶,有 Alkaline Xylanase(GS115)、Neutral protease I(GS115)、α -Amylase(GS115)、Lipase(GS115)、 phytase(KM71)、Laccase(GS115)、β-glucosidase(GS115)、 Trypsin(GS115)等。
但是酵母表達(dá)藥用蛋白的顯著突破,是源于FDA許可的Jetrea®和 Kalbitor®。除此之外,還有Human Insulin(X-33), IgG (ScFv fragment)(X-33), HBsAg(GS115),Recombinant Human Interleukin-6(X-33), Human Parathyroid Hormone(Methylotrophic Pichia strain), Recombinant Human Erythropoietin (rhEPO)(X-33)等[5-7]。
來源于非甲基營(yíng)養(yǎng)型的釀酒酵母表達(dá)系統(tǒng),雖然已經(jīng)有部分重組蛋白藥物上市,但是酵母細(xì)胞表現(xiàn)出的蛋白過度糖基化、低產(chǎn)量和胞內(nèi)質(zhì)粒不穩(wěn)定等缺點(diǎn),限制了其應(yīng)用。所以也會(huì)引入CRIPR/Cas9技術(shù),對(duì)特定位點(diǎn)進(jìn)行突變。如在GlycodExpress™技術(shù)專利中介紹,通過連續(xù)去除釀酒酵母的甘露糖轉(zhuǎn)移酶(MNN1)和糖基轉(zhuǎn)移酶基因,增強(qiáng)了N-糖基化同質(zhì)性,并增加了高爾基體細(xì)胞器中的UDP-GlcNAc的轉(zhuǎn)運(yùn)能力[8]。
1.2釀酒酵母表達(dá)系統(tǒng):
以啤酒酵母為例,其基因組是1996年第一個(gè)被完全測(cè)序完成的真核基因組。在工業(yè)生產(chǎn)乙醇方面,啤酒酵母細(xì)胞,有著pH范圍寬,乙醇和糖濃度高,滲透壓強(qiáng)等眾多特點(diǎn),優(yōu)于細(xì)菌、其他酵母和絲狀真菌[9]。同時(shí)也是最常用的基因表達(dá)調(diào)節(jié)模型,且在信號(hào)轉(zhuǎn)導(dǎo),衰老,凋亡,代謝,細(xì)胞周期控制,細(xì)胞程序性死亡,神經(jīng)退行性疾病,自噬,分泌路徑等重要生物學(xué)過程。啤酒酵母生產(chǎn)的異源糖蛋白,會(huì)導(dǎo)致異常的過度甘露糖基化,并會(huì)導(dǎo)致蛋白活性降低和免疫原性增強(qiáng)。該甘露糖基化修飾的通路,主要與Mnn2p和Mnn11p基因有關(guān)。N-糖基化修飾導(dǎo)致蛋白分泌增加[10]。敲除α-1,6-甘露糖轉(zhuǎn)移酶Och1p,能夠生產(chǎn)出有活性形式的人組織型纖溶酶原激活劑。
1.3漢遜酵母表達(dá)系統(tǒng):
漢遜酵母,即多形漢遜酵母。是一種特殊的甲醇營(yíng)養(yǎng)型酵母,其構(gòu)建的系統(tǒng),可利用強(qiáng)誘導(dǎo)型的啟動(dòng)子如FMD, MOX, GAP等。表達(dá)的異源蛋白可實(shí)現(xiàn)糖基化修飾,可利用完全合成培養(yǎng)基進(jìn)行高密度發(fā)酵,其遺傳背景較為清楚,安全又高效的性能使得近年來被越來越多的研究人員作為最有前景的真核表達(dá)系統(tǒng)。
漢遜酵母有兩個(gè)有效的表達(dá)元件:1.啟動(dòng)外源基因高效表達(dá)的載體系統(tǒng);2.用于篩選標(biāo)記的特殊基因。其篩選標(biāo)記含兩類:一、營(yíng)養(yǎng)缺陷型標(biāo)記,如URA3、LEU2和HIS4等發(fā)生缺失條件無法生長(zhǎng)的宿主菌標(biāo)志基因;二、是顯性選擇標(biāo)記,如抗G418、抗Zeocin基因等。一般基因缺陷型酵母菌的制備,都是通過化學(xué)誘變、雜交或原生質(zhì)體融合等,來獲得對(duì)應(yīng)的標(biāo)記基因。
總之,酵母表達(dá)系統(tǒng)是一個(gè)物美價(jià)廉的藥物表達(dá)宿主。對(duì)于免疫方面,如乙肝疫苗(Engerix-B®)、HPV疫苗(Gardasil®),酵母表達(dá)的疫苗有更強(qiáng)的免疫原性,穩(wěn)定的VLPs結(jié)構(gòu)。
在有相同療效的情況下,酵母表達(dá)藥物的成本更低,如門冬胰島素(NovoRapid®);對(duì)于抗體片段類藥物,Such as Obinutuzumab(Gazyva®)、Caplacizumab(Cablivi®)ADCC更強(qiáng)(糖基化優(yōu)化),組織穿透性更好;表達(dá)細(xì)胞因子Epoetin delta(Dynepo®),也有著更長(zhǎng)的半衰期。
綜上,畢赤酵母、釀酒酵母和漢遜酵母在亞洲區(qū)域的藥企的應(yīng)用較為常見,三種酵母在表達(dá)水平,分泌效率,糖基化能力及其改造難度,基因修飾能力,適合藥物類型的能特點(diǎn)上,均有較大差異。其各自優(yōu)缺點(diǎn)比較,和上市藥物表達(dá)宿主酵母類型,見表1.2、表1.3。
數(shù)據(jù):
2.1標(biāo)準(zhǔn)曲線:
上海賽唐生物藥物殘留相關(guān)產(chǎn)品:釀酒酵母HCP,畢赤酵母X-33 HCP,漢遜酵母HCP ELISA Kit,其4PL擬合R²均達(dá)到0.999,見圖一。
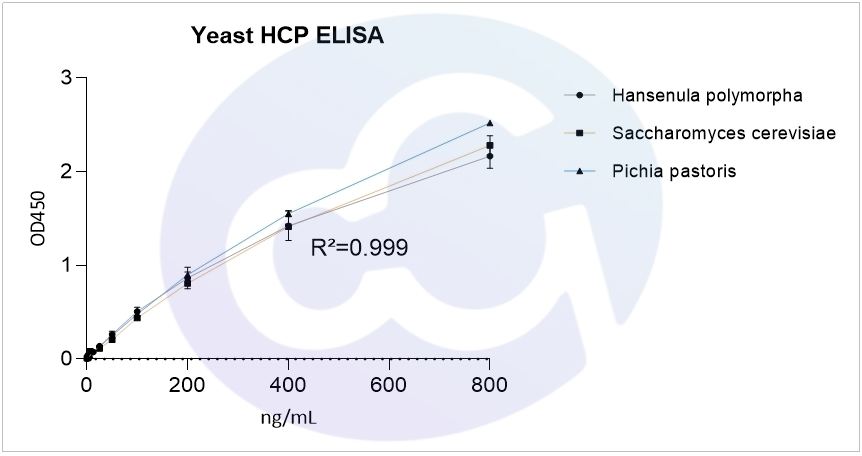
圖一
2.2 質(zhì)控?cái)?shù)據(jù):
畢赤酵母X-33,漢遜酵母和釀酒酵母HCP標(biāo)曲調(diào)試在0-800ng/mL范圍。測(cè)定最低檢測(cè)限和最低定量限。并測(cè)試三種酵母HCP的交叉反應(yīng),和精密度等。另外在特定濃度尿素,鹽濃度和pH條件下,回收率均有優(yōu)異效果,見表2.1。

表2.1
參考標(biāo)準(zhǔn):
ICH Q6B: Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products.
ICH Q7: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients.
ICH S6 (R1).
EMA: Guideline on Immunogenicity assessment of therapeutic proteins (2017).
FDA: Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products (1997).
參考文獻(xiàn):
[1] Fickers, P. Pichia pastoris: A workhorse for recombinant protein production[J]. Current Research in Microbiology and Biotechnology, 2014, 2(3):354-363.
[2] Vanz, A., Lünsdorf, H., Adnan, A., et al. Physiological response of Pichia pastoris GS115 to methanol-induced high level production of the Hepatitis B surface antigen: Catabolic adaptation, stress responses, and autophagic processes[J]. Microbial Cell Factories, 2012, 11(103):1-11.
[3] Stöckmann, C., Scheidle, M., Dittrich, B., et al. Process development in Hansenula polymorpha and Arxula adeninivorans, a reassessment[J]. Microbial Cell Factories, 2009, 8(22):1-10.
[4] Vieira, S. M., da Rocha, S. L. G., da Neves-Ferreira, A. G., et al. Heterologous expression of the anti myotoxic protein DM64 in Pichia pastoris[J]. PLoS Neglected Tropical Diseases, 2017,11(7):1-20.
[5] Meehl MA, Stadheim TA. Biopharmaceutical discovery and production in yeast[J]. Current opinion in biotechnology. 2014, 30:120-127.
[6] Thompson CA. FDA approves kallikrein inhibitor to treat hereditary angioedema[S]. American journal of health-system pharmacy: AJHP: official journal of the American Society of Health-System Pharmacists. 2010, 67(2):93.
[7] Imran Safder, Sajad Khan, Iram-us Islam, et al. Pichia pastoris expression system: a potential candidate to express protein in industrial and biopharmaceutical domains[J]. Biomedical Letters. 2018. 4(1):1-14.
[8] Piirainen, M. A., Boer, H., de Ruijter, J. C., et al. A dual approach for improving homogeneity of a human-type N-glycan structure in Saccharomyces cerevisiae[J]. Glycoconjugate Journal, 2016, 33(2):189-199.
[9] Tesfaw, A., & Assefa, F. Current trends in bioethanol production by Saccharomyces cerevisiae: Substrate, inhibitor reduction, growth variables, coculture, and immobilization[J]. International Scholarly Research Notices, 2014, 2014:1-11.
[10] Tang, H., Wang, S., Wang, J., et al. N-hypermannose glycosylation disruption enhances recombinant protein production by regulating secretory pathway and cell wall integrity in Saccharomyces cerevisiae[J]. Scientific Reports, 2016, 6(1):1-13.
