
編者按
食管腺癌(EAC)作為全球七大常見癌癥之一,是一種極具侵襲性的惡性腫瘤,過去40年間在西方國家的發病率激增約700%,患者5年生存率僅20%。其發病與肥胖、胃食管反流病(GERD)和Barrett食管密切相關。SOX4作為SRY相關的HMG-box(Sox)家族轉錄因子,已被證實是一個潛在的促癌因子,在器官發育和祖細胞分化中起關鍵作用,但其在EAC中的具體作用和分子機制尚不明確。
8月26日,哥倫比亞大學醫學院、浙江大學遺傳學研究所及環特生物等研究團隊在Cancer Letters(IF=10.1)發表最新研究,基于類器官模型等,首次揭示了SOX4通過直接調控SEMA3C表達,來促進食管腺癌進展的分子機制,證實SOX4-SEMA3C軸是EAC進展的關鍵驅動因素,不僅深化了對EAC發病機制的理解,也為EAC靶向治療提供了新的潛在靶點。
本研究中,研究人員基于類器官研究(你開學,我放價丨環特類器官試劑盒開學禮,請領取硬核福利!),揭示了SOX4在EAC中的關鍵作用及其分子機制,并進一步證實了SEMA3C作為EAC治療靶點的潛力,為開發針對EAC的新療法提供了理論基礎。
01 研究亮點
通過類器官、細胞、小鼠模型等多層面驗證了SOX4–SEMA3C軸的功能,首次揭示了SOX4–SEMA3C軸在EAC中的關鍵作用;
利用基因編輯技術及RNA-Seq和ChIP-Seq等多組學整合分析,證實SEMA3C是SOX4的直接靶點,明確了SOX4通過直接調控SEMA3C表達促進腫瘤增殖、上皮間質轉化(EMT) 和轉移的分子機制,揭示了新的信號通路;
利用TCGA數據、組織微陣列和患者來源類器官(PDO)驗證表達與預后關系,臨床相關性高,并首次提出靶向SEMA3C或其受體NRP2/PLXND1可能成為EAC治療新策略。
02 主要研究成果
1. SOX4在EAC中高表達,且與不良預后相關
研究人員通過分析TCGA數據庫和106例EAC樣本的組織微陣列(TMA)發現,在EAC腫瘤組織中,SOX4表達顯著高于正常組織,且SOX4的表達水平與腫瘤分級、患者生存率負相關。實驗數據顯示,93.4%的EAC腫瘤組織表達SOX4,而81.3%的癌旁正常組織幾乎不表達SOX4。此外,OE33、SK-GT-4等EAC細胞系中,SOX4表達顯著高于正常食管上皮細胞。因此,SOX4的高表達與EAC的發生發展密切相關。
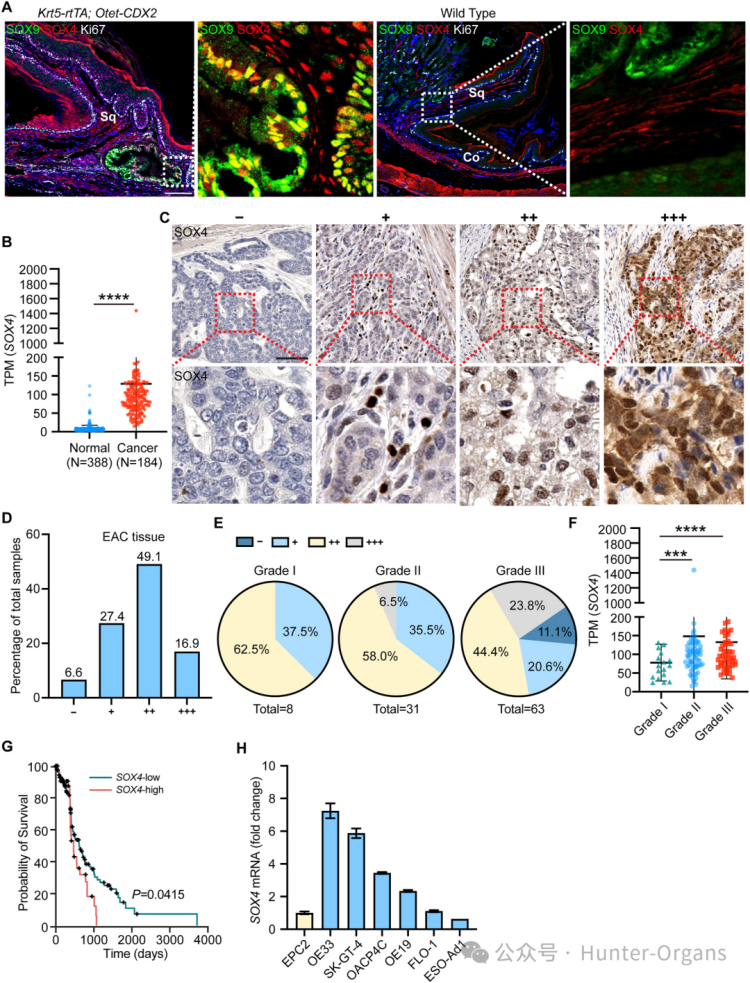
圖1
2. SOX4促進EAC細胞增殖、存活和上皮間質轉化(EMT)
為了探究SOX4在EAC中的功能,研究人員利用shRNA技術在EAC細胞系OE33和SK-GT-4中進行了SOX4敲低實驗,隨后又利用基因編輯技術進行了SOX4敲除實驗。結果顯示,敲低或敲除SOX4顯著抑制EAC細胞增殖,腫瘤球形成能力和體內成瘤能力下降,并誘導細胞凋亡。SOX4過表達時,腫瘤球的數量和大小均增加。這些結果證實了SOX4對EAC細胞的增殖和存活至關重要。
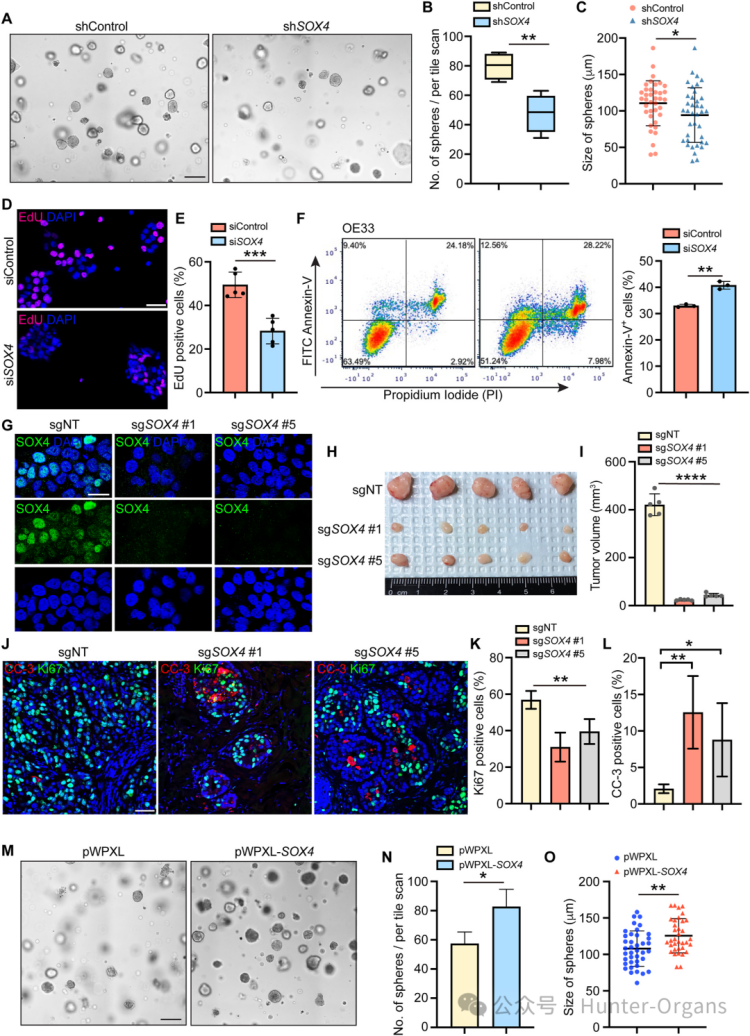
圖2
轉化生長因子β(GF-β)已被證實可以誘導乳腺癌細胞中SOX4的表達,促進EMT的發生。為了探究SOX4在EAC中也可誘導EMT,研究人員進行了直接驗證,發現SOX4過表達會促進上皮-間質轉化(EMT),而抑制SOX4則能逆轉這一過程。結果顯示,在OE33細胞中過表達SOX4,E-cadherin下調、N-cadherin和Vimentin上調;而在SK-GT-4細胞中敲低SOX4,導致N-cadherin和Vimentin均下調。
尾靜脈注射SK-GT-4細胞實驗表明,敲低SOX4顯著抑制了肺轉移結節的形成,降低了EAC細胞的肺轉移能力。這些結果充分證實了SOX4在EAC中能促進上皮間質轉化(EMT)并增強惡性進展。
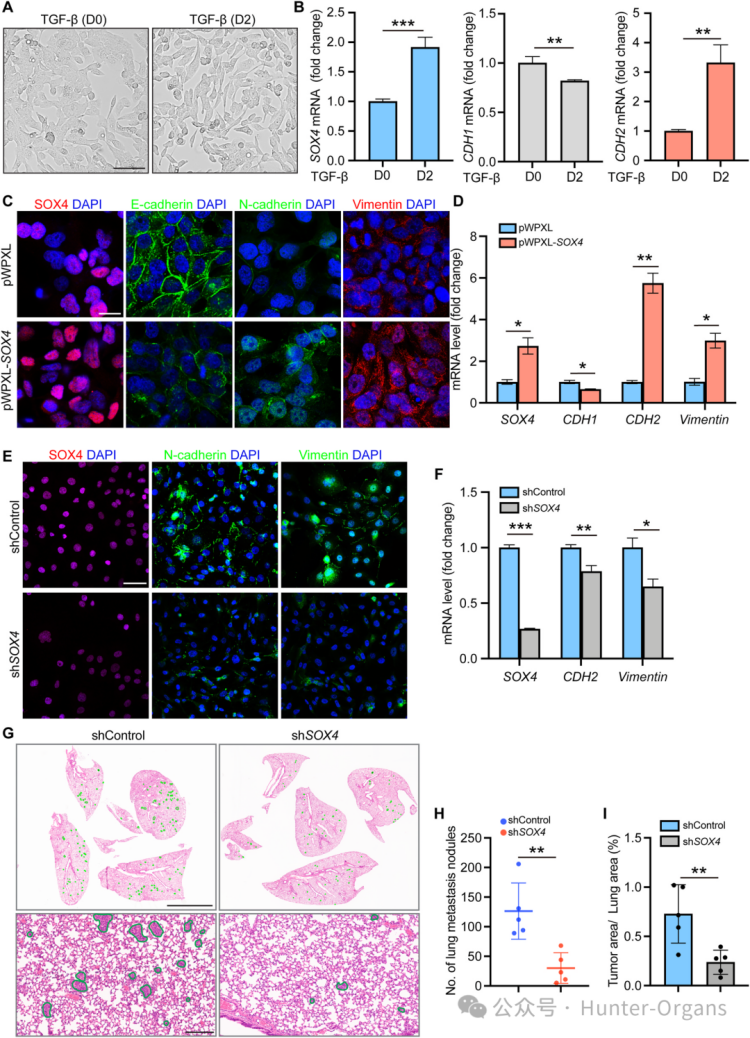
圖3
3. SOX4直接轉錄調控SEMA3C
接著,研究人員通過RNA-Seq和ChIP-Seq聯合分析,篩選出45個SOX4直接靶基因,發現敲低INPP5D、GIT1、CYP27A1 和 SEMA3C這4個基因,能顯著抑制EAC細胞生長,其中,SEMA3C(Semaphorin 3C)是最具功能潛力的候選基因。SEMA3C的表達在SOX4敲低后下降最為明顯,且其在EAC組織和細胞系中也高表達,與患者不良預后相關。
ChIP-PCR和熒光素酶報告實驗證實,SOX4直接結合SEMA3C啟動子區域,并激活其轉錄。免疫熒光染色進一步證實,SOX4與SEMA3C在EAC組織和單細胞水平上共表達。這些結果表明,SOX4調節EAC細胞中SEMA3C的轉錄。
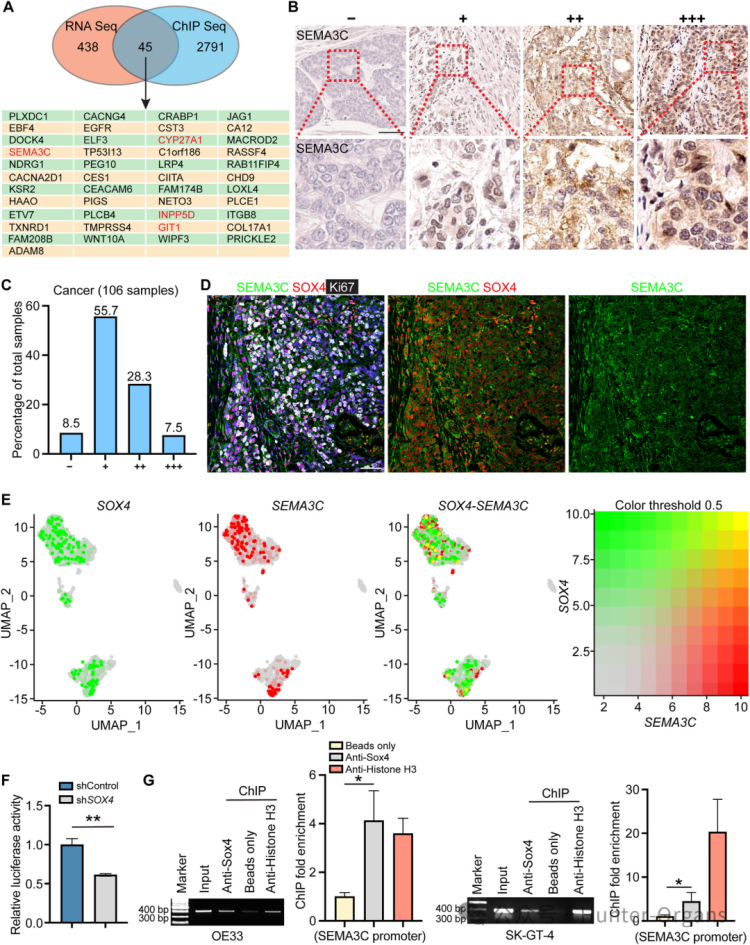
圖4
4. SEMA3C能促進EAC進展
本研究中,研究人員在OE33和SK-GT-4細胞中使用ShRNA敲低SEMA3C,結果發現,敲低SEMA3C可顯著抑制EAC細胞的增殖、腫瘤球形成和體內腫瘤生長,并逆轉EMT表型,表現為N-cadherin和Vimentin下調。反之,在OE33細胞中過表達SEMA3C,導致N-cadherin和Vimentin升高,E-cadherin降低。因此,SEMA3C對EAC細胞的生長、存活和EMT過程是必需的。
在OE33和SK-GT-4細胞中,NRP2和PLXND1受體表達水平較高。利用SiRNA敲低NRP2和PLXND1,結果顯示,NRP2和PLXND1的敲低均能顯著抑制OE33和SK-GT-4細胞的生長,并誘導SK-GT-4細胞中Vimentin和N-cadherin的表達降低。因此,SEMA3C通過其受體NRP2和PLXND1,在EAC中發揮促生長和促EMT的作用。此外,研究人員也探究發現,使用SEMA3C特異性反義寡核苷酸(ASO),可有效抑制EAC細胞增殖,這顯示了其作為治療靶點的潛力。
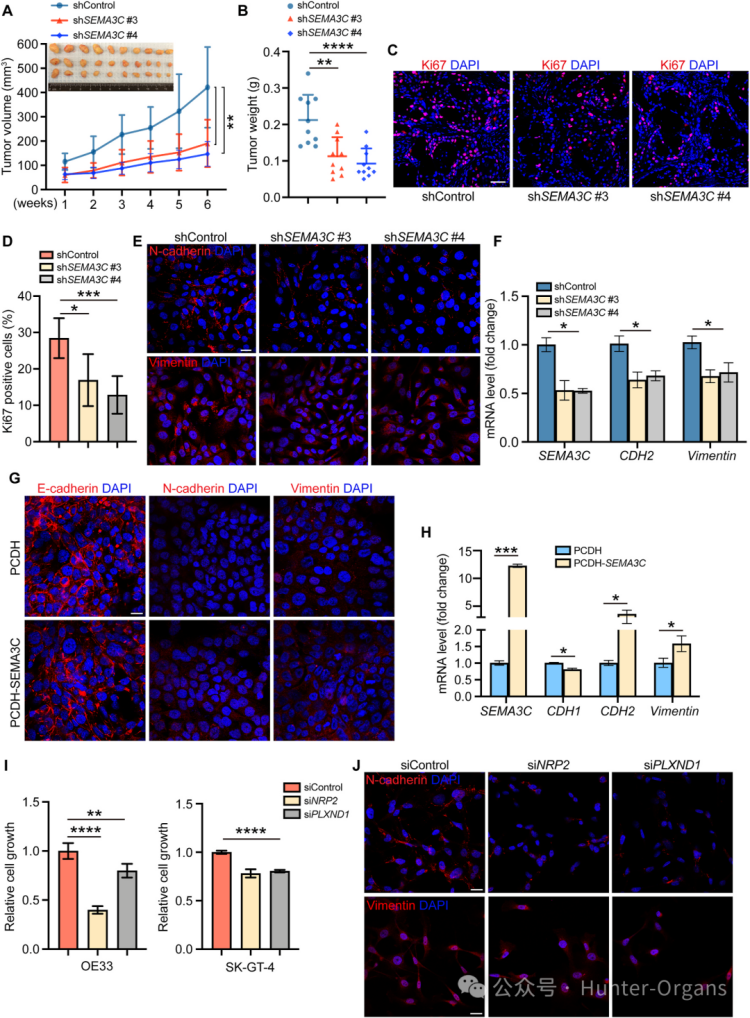
圖5
5. SOX4通過SEMA3C促進EAC進展及上皮間質轉化(EMT)
在患者來源的類器官(PDO)模型中,SOX4和SEMA3C均高表達。研究人員在類器官模型中敲低SOX4,類器官數量和大小顯著減少;在OE33細胞中過表達SOX4,確認其能顯著上調SEMA3C的轉錄水平。
為了確認SEMA3C是SOX4發揮作用的關鍵下游因子,研究人員在SOX4敲低的EAC細胞中過表達SEMA3C。結果顯示,在OE33細胞中,過表達SEMA3C可部分挽救SOX4缺失導致的細胞增殖和EMT表型逆轉。因此,SEMA3C是SOX4在EAC中發揮促生長和促EMT功能的一個重要下游效應分子。
這些結果表明,SOX4-SEMA3C軸是EAC進展的關鍵驅動因素,SOX4在EAC中高表達,并通過直接上調其下游靶基因SEMA3C的轉錄,來促進EAC的生長、上皮間質轉化(EMT)和轉移,而且,SOX4、SEMA3C及其受體NRP2、PLXND1均為潛在的治療靶點。
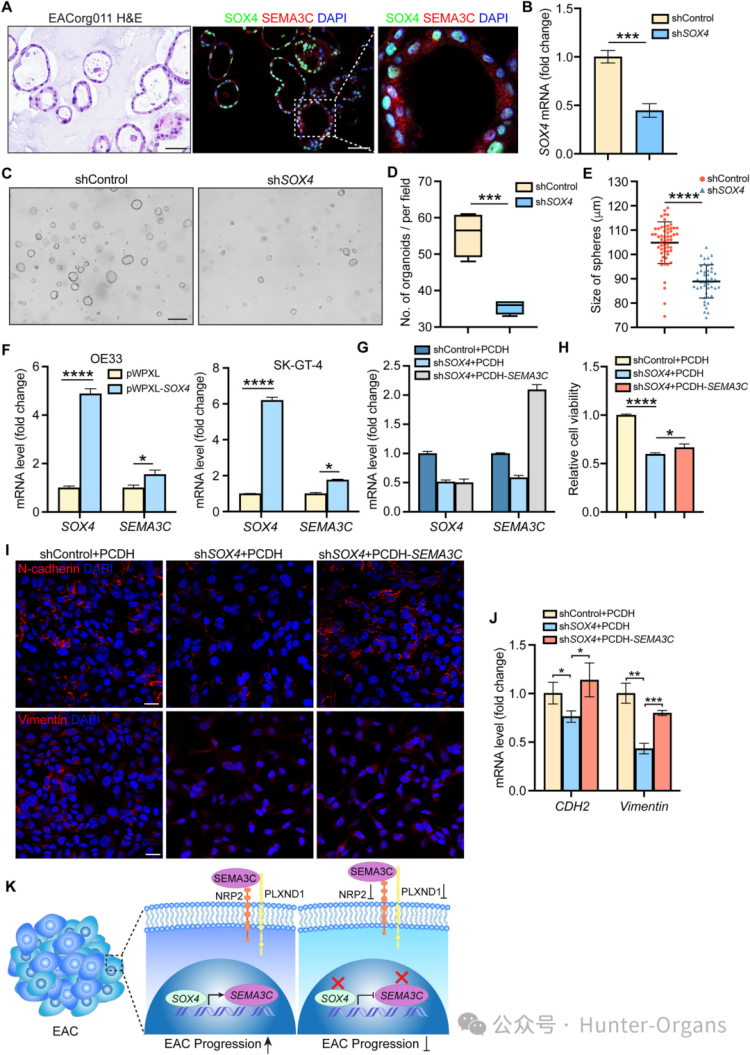
圖6
為了更好地利用類器官模型,助力腫瘤及生命科學研究,環特科研創新部特推出類器官試劑盒開學禮,涵蓋環特自主研發的胃癌、結直腸癌、小鼠小腸、小鼠結腸、人小腸、人結腸、人胃上皮類等一系列熱門類器官培養試劑盒,可有效建立和維持人源、動物源及iPSC來源類器官的培養、誘導分化,用于組織來源類器官培養、疾病模型構建等,歡迎新老客戶參與咨詢!
詳情請點擊:你開學,我放價丨環特類器官試劑盒開學禮,請領取硬核福利!
03 編者點評
本研究首次系統揭示了SOX4-SEMA3C信號軸在EAC進展中的關鍵作用,發現SOX4通過直接轉錄激活SEMA3C表達,進而促進EAC細胞增殖、存活、EMT和轉移,并強調了SEMA3C作為EAC治療靶點的潛力,不僅深化了對EAC發病機制的理解,也為開發針對EAC的新療法提供了理論基礎。
作為健康美麗產業CRO服務開拓者與引領者、斑馬魚生物技術的全球領導者,環特生物搭建了“斑馬魚、基因編輯、類器官、哺乳動物、人體”等多維生物技術服務體系,開展健康美麗CRO服務、科研服務、智慧實驗室搭建三大業務。目前,環特已建立200多種斑馬魚模型,腦類器官、胃癌、心臟類器官及各種腫瘤類器官培養平臺,歡迎有需要的讀者垂詢!
參考文獻:
Tala Fnu, et al. The SOX4-Semaphorin3C axis promotes esophageal adenocarcinoma progression. Cancer Letters. 2025. DOI: 10.1016/j.canlet.2025.218005
Cancer Letters丨類器官模型證實SOX4-SEMA3C軸是食管腺癌進展的“加速器”!
