CRISPR/Cas系統是細菌和古細菌在不斷進化的過程中產生的適應性免疫防御機制,它應用CRISPR RNA(crRNA)以堿基互補的形式引導相應的Cas蛋白識別入侵的外源基因組,并對其DNA進行剪切,用以保護自身的基因組免受外源核酸如噬菌體、病毒等的干擾和破壞。經過人為改造后,可在真核細胞中實現高度靈活且特異的基因組編輯,通過設計特異性向導RNA(Single guide RNA, sgRNA)序列與靶序列進行堿基配對,從而引導Cas蛋白結合到靶序列處,行使DNA切割功能,然后利用細胞的非同源性末端連接(Non-homologous end joining, NHEJ)或同源重組(Homologous recombination,HR)修復機制對斷裂的DNA進行插入缺失(Indel)、修復(Repair)或替換(Replacement)。由于其相對于鋅指核酸酶(ZFNs)和轉錄激活因子樣效應物核酸酶(TALENs)技術更易于操作,而且更高效,因而被廣泛運用于對基因組特定位點進行靶向編輯。
由于設計的sgRNA會與非靶點DNA序列錯配,引入非預期的基因突變,即脫靶效應(Off-target effects)。脫靶效應造成了研究中的許多不確定性,這無疑限制了該技術的應用。因此,研究者希望能開發有效的方法來檢測脫靶效應。
在目前主流的脫靶效應評估方法中,有一種方法為GUIDE-seq,其原理是利用一種短的雙鏈寡聚核苷酸(dsODN)標記CRISPR/Cas誘導的脫靶斷裂,然后對標簽所在的基因組區域進行高通量測序,通過生物信息學分析從而確定脫靶位點。利用該技術可以在基因組范圍內檢測CRISPR脫靶效應,從而改變了以往先預測假定脫靶位點再檢測的思路;與其他的評估方法相比,GUIDE-seq更精確、更靈敏。目前鼓潤已掌握了該項技術,簡述如下:
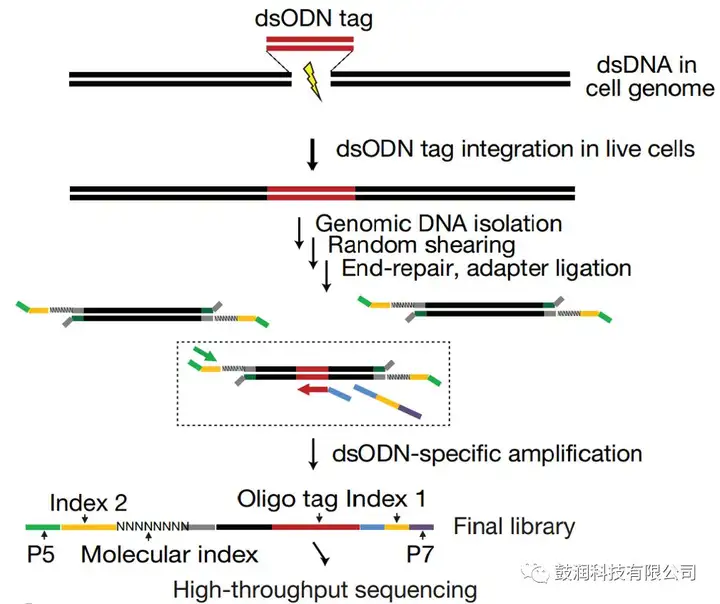
1、CRISPR與dsODN tag整合的實驗技術及高通量測序建庫流程
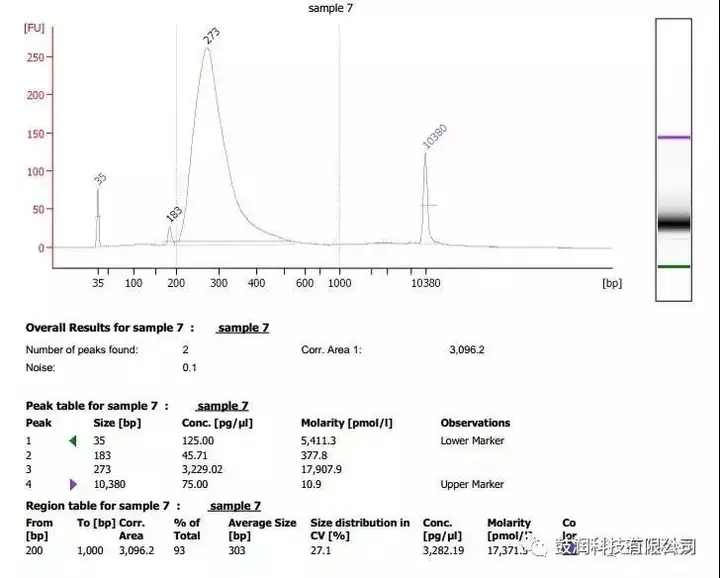
將靶向于目標基因組位點的CRISPR質粒與dsODN tag以核電轉的方式同時轉染入真核細胞,CRISPR造成基因組雙鏈斷裂后,dsODN tag將整合入斷點處,作為后續分析在靶與脫靶情況的標記。轉染后3天收集細胞的DNA進行高通量建庫。
?
?
?
2、GUIDE-seq生信分析方法
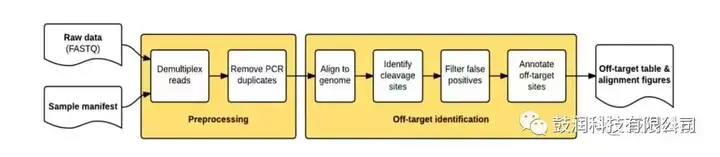
1)搭建了高通量測序的數據分析流程
?
?
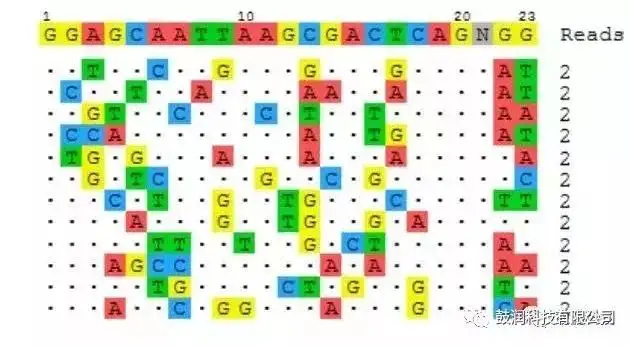
2)利用該技術分析了CRISPR靶向編輯某細胞系基因的在靶與脫靶情況。其中一例樣品的分析結果如圖4所示:
?
?
Sequences of off-target sites identified by GUIDE-seq. The intended target sequence is shown in the top line with cleaved sites shown underneath and with mismatches to the on-target site shown and highlighted in color. GUIDE-seq sequencing read counts are shown to the right of each site.
3)利用PCR擴增技術聯合Sanger測序鑒定了分析出的脫靶位點
?
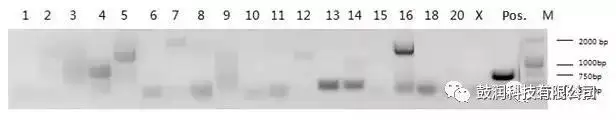
?
?
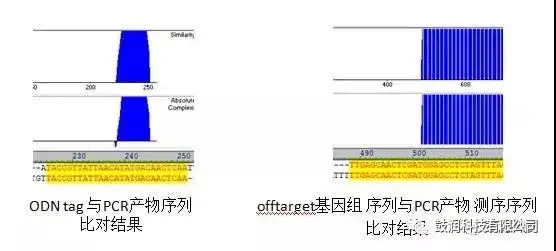
?
?
GUIDE-Seq脫靶評估技術的優勢分析
舒桐致力于基因組編輯工具脫靶的分析檢測工作,為篩選、優化基因組編輯工具的保真性提供標準化的分析。我們脫靶分析具有如下優勢:
- 實用性強:能反映CRISPR在真核細胞中進行基因編輯的在靶與脫靶情況,以進行安全性和有效性評價
- 檢測通量高:一次能檢測多個樣本的在靶與脫靶情況,并通過優化的標簽設計,降低實際的測序reads數量
- 準確性高:絕大部分檢測結果可被驗證
- 靈敏度高:能夠高效檢測出低頻脫靶位點,檢測低至0.1%的脫靶突變
- 實驗難度低:操作過程簡單易行
- 細胞適應性強
關于舒桐
?
如需獲得更多信息,請咨詢我們:
電話:
400-6309596
15022705442(同微信)
企業官網:
http://www.generulor.com
產品訂購/技術支持:
service@generulor.com
參考文獻
[1]Tsai, S. Q. et al. GUIDE-seq enables genome-wide profiling of off-target cleavage by CRISPR-Cas nucleases. Nat Biotechnol 33, 187–97 (2015).
