小鼠iCD1完全誘導培養基 8.29-9.29在丁香通有6折開學促銷活動。
鏈接如下:
http://www.biomart.cn/act/201609_kaixuecuxiao_cellculture_part.htm.htm
iCD1小鼠iPS誘導完全培養基
iCD1完全培養基是一種無血清、無動物源污染、化學成分確定的高效獲得小鼠誘導多能干細胞
(iPS細胞)的培養基。該培養基可在無飼養層細胞、不分盤的條件下維持從體細胞向iPS細胞
轉化過程中的細胞生長和增殖,同時顯著加速iPS細胞誘導進程,極大地提搞iPS細胞的轉導
效率。
優點
無血清、無動物源污染、化學成分確定
體系穩定,批次重復性
支持少因子誘導體細胞重編程
極大縮短iPS誘導時間(一周),提高iPS誘導效率(10%)
使用簡便,無需添加額外的生長因子或其他添加物
|
產品編號 |
品名 |
規格 |
存儲條件 |
|
820210 |
iCD1完全培養基 |
100mL |
-20℃ |
iCD1培養基誘導iPS細胞操作步驟
成纖維細胞導入重編程因子->每天更換iCD1培養基->第7-8天挑取克隆
重編程效果

干細胞特異分子標記物Nanog和內源性Oct4的相對表達量被用于評價細胞整體重編程進程的快慢。
圖2a表明,在DeliCell??iCD1培養條件下,Nanog 和內源Oct4的激活明顯快于mES和KSR-BN組。
圖2b為蛋白水平上驗證多能性分子標記物的表達結果圖。
結果表明,第8天在原盤出現的重編程克隆其多能性分子標記物Cdh1,SSEA-1和Nanog均有表達。
圖2c為將mES和iCD1培養條件下第4天和第8天的培養物提取總蛋白,采用Western-blot檢測Nanog
的表達狀況,實驗結果表明,感染后第8天,在DeliCell??iCD1培養條件下, Nanog表達顯著,而
在對照組mES條件下,Nanog則未表達。該結果也進一步證明了iCD1培養條件下重編稱過程顯著
加快。

圖2 從分子水平上證明DeliCell??iCD1培養體系優于其他培養體系。
重編程后期外源因子沉默,是判斷完全重編程的一個指標。
圖3為采用紅色熒光蛋白Ds-Red用于模擬外源轉錄因子的沉默,將Ds-Red和OKS一起感染細胞,
在DeliCell??iCD1培養條件下,不同時間點,熒光顯微鏡跟蹤觀察細胞綠光(指示內源多能性
Oct4的表達)和紅光(指示外源因子的表達狀況)。
結果顯示,隨著時間的延長,綠光逐漸增強,紅光逐漸減弱,第8天基本不表達紅光,
表明重編程后期外源因子的沉默,重編程基本完成。
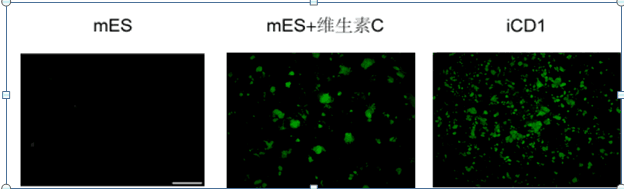
圖3 體細胞重編過程示蹤

4.2采用iCD1和少因子(OK或OS)誘導小鼠多能干細胞
圖4a是在DeliCell??iCD1培養條件下,OK和OS重編程克隆的原始照片和傳代照片。
圖4b表明OK和OS重編程獲得的iPS克隆表達干細胞特異性分子標記。
圖4c為Oct4/KLf4和Oct4/Sox2重編程實驗結果統計,表中給出了每次實驗計算重編程克隆的時間和
統計結果,三次試驗結果表明試驗具有較好的重復性。圖4d為OK和OS克隆注射裸鼠長出的畸胎瘤
組織切邊,組織切片中明顯的三個胚層的組織分化表明OK和OS克隆具備向三個胚層細胞分化的潛
能。這些數據有力地證明了在iCD1培養條件下,少因子(OK或OS)能夠將小鼠成纖維細胞誘導重
編程。

圖4 少因子的重編程實驗
5.4.3?采用iCD1和單因子Oct4誘導小鼠多能干細胞
MEF細胞用Oct4病毒經過兩輪感染后,在iCD1中培養,連續培養30天后,將培養物用胰酶消化
傳代種植到飼養層細胞上,用iCD1繼續培養,在傳代后的第5天左右,發現有綠色重編程克隆出
現,如圖5a所示。通過免疫熒光檢測發現這些克隆均表達多能性分子標記如Nanog,SSEA-1
和Rex1,結果如圖5b所示。
圖5c通過實時熒光定量PCR檢測多能性marker的表達狀況,結果表明這些克隆表達內源Oct4、
Nanog、Rex1、Dppa3、Dnmt3l的水平與標準的胚胎干細胞類似。
圖5d是通過實時熒光定量PCR方法分析外源基因的表達狀況。OKS感染后4天的Oct4-GFP小鼠
胚胎成纖維細胞作為陽性對照。
結果顯示挑取的這些重編程克隆,外源轉錄因子均已沉默。插入鑒定檢測結果表明 (圖5e),挑取的
克隆不是因為病毒污染引起。
圖5f為Oct4重編程克隆細胞注射囊胚產生的嵌合體小鼠。產生的嵌合體公鼠與白色品系小鼠產下
全黑色小鼠(圖5g) ,該結果證明Oct4重編程克隆為生殖系嵌合。
上述結果證明嚴格證明Oct4重編程細胞與胚胎干細胞類似,從而證明了在iCD1培養條件下,
Oct4可將小鼠胚胎成纖維細胞完全重編程。
1.?培養基相關文獻列表:
?
1. Chen, J. et al. Rational optimization of reprogramming culture conditions for the generation
of induced pluripotent stem cells with ultra-high efficiency and fast kinetics. Cell research 21,
884-894 (2011).
2. Bar-Nur, O. et al. Small molecules facilitate rapid and synchronous iPSC generation.
Nature methods 11, 1170-1176 (2014).
3. Buganim, Y. et al. The developmental potential of iPSCs is greatly influenced by
reprogramming?factor selection.Cell stem cell 15, 295-309 (2014).
4. Chen, J. et al. BMPs functionally replace Klf4 and support efficient reprogramming of mouse
fibroblasts byOct4 alone.Cell research 21, 205-212 (2011).
5. Chen, J. et al. Vitamin C modulates TET1 function during somatic cell reprogramming.
Nature genetics 45, 1504-1509 (2013).
6. Papp, B. & Plath, K. Epigenetics of reprogramming to induced pluripotency.
Cell 152, 1324-1343 (2013).
7. Liu, J. et al. The oncogene c-Jun impedes somatic cell reprogramming.
Nature cell biology 17, 856-867 (2015).
8. Chen, J. et al. BMPs functionally replace Klf4 and support efficient reprogramming of
mouse?fibroblasts by Oct4 alone.Cell research 21, 205-212 (2011).
9. Wang, Y. et al. Reprogramming of mouse and human somatic cells by high-performance
engineered factors.EMBO reports 12, 373-378 (2011).
10. Ouyang, J. et al. Cyclin-Dependent Kinase-Mediated Sox2 Phosphorylation Enhances the
Ability of Sox2 to Establish the Pluripotent State. The Journal of biological chemistry (2015).
?
|
? |
品牌:Delicell |
|
|
? |
? | |
?
