表面等離子共振(surface plasmon resonance,SPR)技術是一種基于物理光學原理的研究生物分子相互作用的技術,起源于上世紀80年代。隨著對SPR性能和儀器系統的不斷改進,以及對不同生化樣本的測試,目前該技術已廣泛應用于藥物先導化合物的篩選。SPR在藥物研發中發揮著重要作用,適用于藥物篩選、藥物-靶標相互作用研究和藥物代謝動力學研究等領域。作為分子互作檢測的“金標準”,SPR已廣泛應用到藥物的研發、生產與臨床申報等。美迪西的SPR分子互作服務平臺可以提供藥物-靶點、抗體-抗原及蛋白-蛋白的親和力(K,)和動力學參數測定,評估候選分子與靶點的結合模式,支持結構優化,以及測試不同分子在相同靶點上的競爭能力,優化藥物開發策路等服務。
下面我們看一下SPR的組成部分、工作原理、技術特點,以及SPR技術在生物醫藥領域的應用前景。
01 SPR設備系統
SPR由三個核心部件(光學檢測系統、傳感器芯片和微流控系統),及其他部件組成。
光學檢測系統
用于檢測傳感器芯片表面附近的折射率變化。在分子相互作用過程中,分子之間的結合會改變折射率,導致共振角相對于結合分子的質量成比例變化,從而能夠靈敏地檢測分子相互作用。
傳感器芯片
通過表面修飾的功能基團偶聯生物分子。傳感器芯片是核心部件。傳感芯片又分為三個主要組成部分,分別是光波導耦合器件、金屬膜以及分子敏感膜。傳感器芯片通過共價連接、高親和力捕獲和疏水吸附等方法偶聯生物分子。
微流控系統
包括兩個液體傳送泵,精確輸送緩沖液和樣品,確保它們在傳感器芯片上的均勻分布,從而提高檢測靈敏度。
其他部分等
包括例如LED狀態指示器和溫度控制系統等。
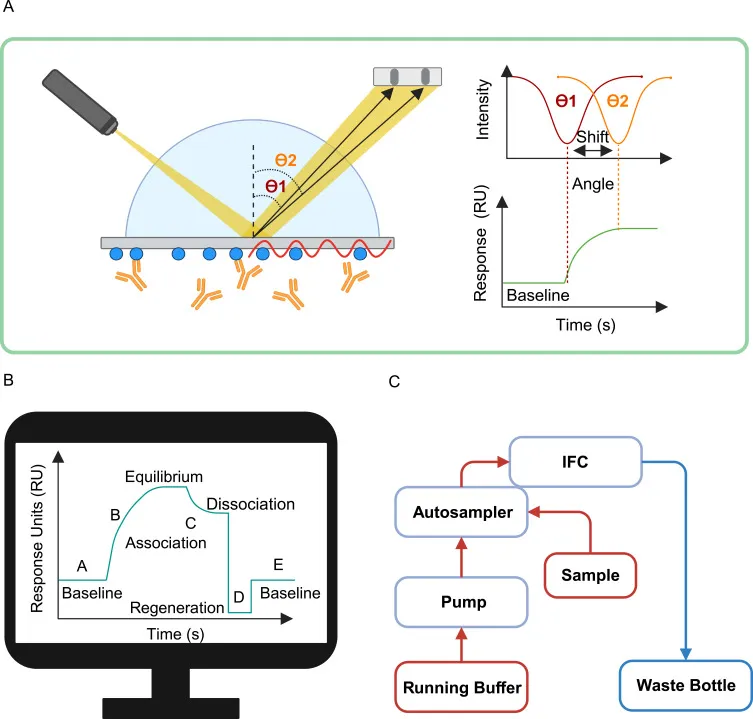
SPR儀器的主要組成部分: (A) SPR 光學檢測系統 (B) 信號采集系統 (C) 微流控系統[1]
02 SPR工作原理
當光線與傳感器芯片的金屬膜層上的等離子體振蕩相互作用時,會發生共振現象。在SPR實驗中,通常將一種生物分子(如蛋白)固定在傳感器芯片的金屬膜層表面,再通過微射流卡盤將含有相互作用的分子溶液傳送至傳感器芯片表面,當它們相互結合時,引起共振角發生變化。通過監測這種共振角的變化,可以定量分析生物分子的親和力、結合動力學等參數。SPR光學檢測系統則跟蹤檢測溶液與芯片表面的分子結合和解離的全過程。
由于其高度的自動化和靈敏特異性且具常規儀器方法難以比擬的實時,動態監測優點,所以SPR被廣泛地應用于各種生命現象分子機理研究。隨著SPR技術的發展,各種SPR檢測模式被開發出來以滿足特定的應用需求。不同的SPR檢測模式在生物醫學研究和應用中具有廣泛的應用,提供了有關生物分子相互作用、結合動力學以及納米顆粒與生物系統之間相互作用的詳細信息。
03 SPR技術特點
(1)實時動態監測
(2)樣品無需標記
(3)樣品需求量低
(4)檢測過程快速
(5)高通量,高靈敏度,高效率等
04 SPR應用前景
SPR技術已成為藥物發現和基礎研究的重要工具,廣泛應用于生物醫學領域,如蛋白-蛋白相互作用、蛋白-小分子藥物相互作用、核酸-蛋白質相互作用、核酸-核酸相互作用、抗體-抗原分子親和力測定等。通過SPR技術,可以實時、動態地監測生物分子間的結合過程,獲取結合動力學參數(如結合速率常數,解離速率常數,平衡解離常數等),從而深入理解分子間的相互作用機制。此外,SPR技術還可用于藥物開發、篩選、疾病診斷等領域。
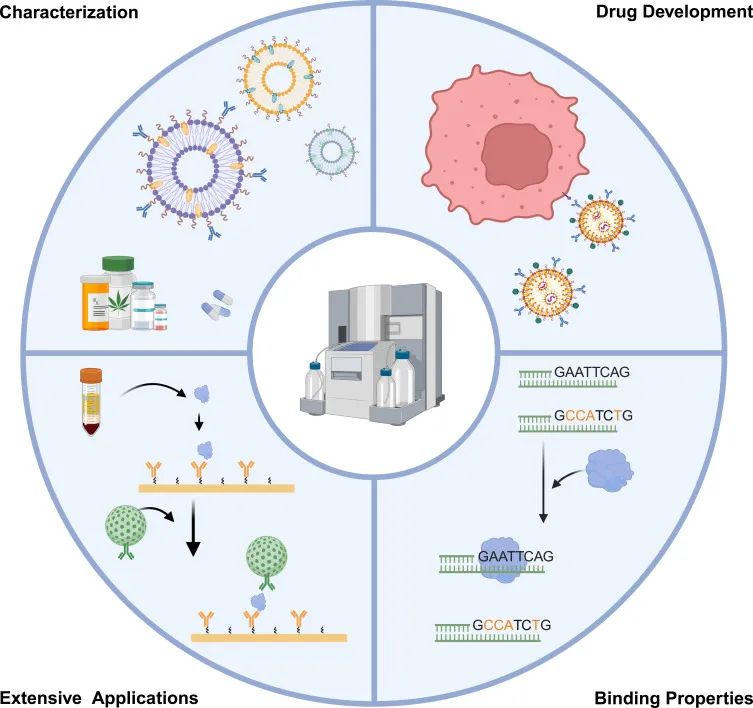
The application of SPR technology[1]
總結
了解生物分子間的相互作用有助于深入理解復雜的生物學過程,并為疾病的預防和治療提供新視角。SPR分子互作技術憑借其實時性、靈敏性、多樣性和靈活性,在生物醫學研究和藥物研發等領域發揮著關鍵作用。通過SPR技術,我們可以更全面地探索生物分子之間的相互作用,支持藥物研發和疾病診斷。隨著SPR技術的持續進步,我們對分子相互作用的認識將愈加深入,為生命科學研究開辟更多可能。
參考資料:
[2] Jingyao Zhang, et al. Application and Method of Surface Plasmon Resonance Technology in the Preparation and Characterization of Biomedical Nanoparticle Materials. Int J Nanomedicine. 2024 Jul 11:19:7049-7069. doi: 10.2147/IJN.S468695.
[3] Tam Vo, et al. Biosensor-surface plasmon resonance: A strategy to help establish a new generation RNA-specific small molecules. Methods. 2019 Sep 1:167:15-27. doi: 10.1016/j.ymeth.2019.05.005.
[4] Asa Frostell, et al. Protein-Ligand Interactions Using SPR Systems. Methods Mol Biol. 2013:1008:139-65. doi: 10.1007/978-1-62703-398-5_6.

